硫化亜鉛(ZnS)は、亜鉛と硫黄から構成される化合物です。発光材料、オプトエレクトロニクス、LEDディスプレイ用蛍光体など、さまざまな用途に使用されています。
| IUPAC名 | 硫化亜鉛 |
| 分子式 | ZnS |
| CAS番号 | 1314-98-3 |
| 同義語 | 閃亜鉛鉱、閃亜鉛鉱、閃亜鉛鉱、ウルツ鉱 |
| インチチ | InChI=1S/S.Zn |
硫化亜鉛の性質
硫化亜鉛の配合
硫化亜鉛の化学式は ZnS で、亜鉛 (Zn) 原子と硫黄 (S) 原子の組成を示します。この化合物は、その独特の特性により、さまざまな産業および科学用途の重要な部分を形成します。
硫化亜鉛のモル質量
硫化亜鉛のモル質量は 1 モルあたり約 97.45 グラムです。この値は、単一の ZnS 分子内の構成原子である亜鉛原子と硫黄原子の合計原子量を表します。
硫化亜鉛の沸点
硫化亜鉛は、加熱すると真の沸騰プロセスを経ずに分解する傾向があるため、明確な沸点がありません。この特性はその化学的特性に起因します。
硫化亜鉛の融点
硫化亜鉛の融点は約摂氏 1,850 度 (華氏 3,362 度) です。融点が高いため、さまざまな高温用途に適しています。
硫化亜鉛の密度 g/mL
硫化亜鉛の密度は結晶形によって異なります。一般に、その密度は 3.98 ~ 4.09 グラム/立方センチメートル (g/cm3) です。この密度範囲は、光学材料での使用に貢献します。
硫化亜鉛の分子量
硫化亜鉛の分子量は、その成分の原子量を加算して計算すると、1 モルあたり約 97.45 グラムです。この値は、特定のサンプル中の ZnS の量を決定するために重要です。
硫化亜鉛の構造
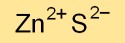
硫化亜鉛は、主に立方晶閃亜鉛鉱(閃亜鉛鉱としても知られる)および六方晶ウルツ鉱として、さまざまな結晶構造で存在します。これらの原子の配置によって、その物理的および光学的特性が決まります。
硫化亜鉛の溶解度
硫化亜鉛は水に溶けにくいため、ほとんど溶けません。この特性は、亜鉛と硫黄原子間の強い結合によるもので、その結果、水溶液への溶解が制限されます。ただし、特定の条件下では特定の酸またはアルカリに溶解することがあります。
| 外観 | 固体 |
| 比重 | 3.98 – 4.09 g/cm3 |
| 色 | 白、黄、茶色、黒 |
| 匂い | 無臭 |
| モル質量 | ~97.45 g/モル |
| 密度 | 3.98 – 4.09 g/cm3 |
| 融合点 | ~1850°C (~3362°F) |
| 沸点 | 分解された |
| フラッシュドット | 適用できない |
| 水への溶解度 | 実質的に不溶性 |
| 溶解性 | 特定の条件下で酸、アルカリに可溶 |
| 蒸気圧 | 無視できる |
| 蒸気密度 | 適用できない |
| pKa | ~4.7 |
| pH | ~7 (ニュートラル) |
硫化亜鉛の安全性と危険性
硫化亜鉛は急性毒性は低いですが、加熱すると有毒な二酸化硫黄を放出する可能性があります。通常、通常の取り扱い条件下では安全であると考えられています。ただし、粉塵や蒸気を吸入すると呼吸器官への炎症を引き起こす可能性があります。皮膚や目との接触を避けてください。暴露した場合は、十分に洗い流し、刺激が続く場合は医師に相談してください。火災や過度の熱により分解が起こり、有害なガスが発生する可能性があります。混触しない物質から遠ざけて保管してください。安全を確保し、硫化亜鉛に関連する潜在的な危険を防ぐために、慎重に取り扱い、適切な保護具を着用し、換気の良い場所で作業してください。
| ハザードシンボル | なし |
| セキュリティの説明 | 急性毒性が低い。加熱すると有毒な二酸化硫黄ガスを放出します。取り扱い注意 |
| 国連識別番号 | 適用できない |
| HSコード | 2830.90.10 |
| 危険等級 | 危険物として分類されていない |
| 梱包グループ | 適用できない |
| 毒性 | 毒性が低い。粉塵や煙による呼吸器への刺激。取り扱い注意 |
硫化亜鉛の合成法
硫化亜鉛はさまざまな方法で合成できます。一般的なアプローチは、酸化亜鉛 (ZnO)と硫化水素 (H2S) ガスを高温で反応させることです。反応は次のように進行します。
ZnO (s) + H2S (g) → ZnS (s) + H2O (g)
別の方法には、塩化亜鉛 (ZnCl2)と硫化水素ガスの反応が含まれます。
ZnCl2 (aq) + H2S (g) → ZnS (s) + 2 HCl (g)
あるいは、硫化亜鉛ナノ粒子は、沈殿法を使用して合成できます。これには、制御された条件下で可溶性亜鉛塩と可溶性硫化物塩を混合し、硫化亜鉛ナノ粒子を形成することが含まれます。場合によっては、粒子サイズと安定性を制御するために有機化合物がキャッピング剤として使用されます。
硫化亜鉛は、金属亜鉛を元素状硫黄と反応させることによっても調製できます。 2 つの物質を一緒に加熱して反応を開始します。
Zn(s) + S(s) → ZnS(s)
これらの方法は、オプトエレクトロニクス、発光材料など、さまざまな用途に合わせてさまざまな特性を持つ硫化亜鉛を製造する多用途性を提供します。
硫化亜鉛の用途
硫化亜鉛は、その独特の特性により、さまざまな産業でさまざまな用途に使用されています。その注目すべき用途は次のとおりです。
- 光学コーティング: 硫化亜鉛は赤外線領域で透明であるため、赤外線画像システムやセンサーの光学コーティング、レンズ、窓に貴重な材料となります。
- 発光材料: 暗闇で光る用途向けの銅ドープ硫化亜鉛などの発光化合物を作成するためのホスト材料として機能します。
- 半導体用途: 薄膜トランジスタやその他の半導体デバイスにおいて、硫化亜鉛膜は電子部品としての役割を果たします。
- LED ディスプレイ蛍光体: LED ディスプレイは、色と明るさを向上させるために硫化亜鉛蛍光体を使用します。
- X 線およびガンマ線の検出: シンチレーション検出器は、硫化亜鉛のシンチレーション特性を利用して X 線およびガンマ線を検出します。
- 顔料と塗料: 塗料、コーティング、印刷インキの白色顔料には、亜鉛華やリトポンなどの特定の形態の硫化亜鉛が使用されます。
- 蛍光マーカー: 生物学的応用では、研究者は画像研究における蛍光マーカーとして硫化亜鉛ナノ粒子を機能化します。
- 太陽電池: 科学者は、太陽光発電太陽電池の光吸収を改善する可能性を判断するために、硫化亜鉛ナノ粒子を研究しています。
- 触媒作用: 研究者は、硫化亜鉛の半導体としての性質を探求し、さまざまな化学反応における硫化亜鉛の触媒特性を研究しています。
- 赤外線窓: 赤外線窓に硫化亜鉛を組み込んだカメラ、望遠鏡、センサーなどの光学機器。
硫化亜鉛の多用途性は、ルミネッセンス、透明性、および半導体挙動を示す能力から生まれます。そのオーダーメイドのアプリケーションは、光学、エレクトロニクス、エネルギー、材料科学などの分野に大きく貢献します。
質問:
Q: 硫化亜鉛の式は何ですか?
A: 硫化亜鉛の化学式は ZnS です。
Q: 硫化亜鉛は水溶性ですか?
A: 硫化亜鉛は一般に水に溶けません。
Q: ZnS は水に溶けますか?
A: いいえ、ZnS は水に溶けません。
Q: 硫化亜鉛には亜鉛が 67.1 質量%含まれています。硫化亜鉛中の硫黄の質量分率は何ですか?
A: 硫化亜鉛中の硫黄の質量分率は 32.9% です。
Q: 硫化亜鉛から塩化亜鉛をどのように分離できますか?
A: 塩化亜鉛と硫化亜鉛は、塩化亜鉛を水に溶解し、不溶性の硫化亜鉛を残すことで分離できます。
Q: 硫化亜鉛はイオン性ですか?
A: はい、硫化亜鉛は主にイオン性です。
Q: ZnS はどのような種類の化学量論的欠陥を表しますか?
A: 硫化亜鉛はフレンケル型の化学量論的欠陥を示す可能性があります。
Q:ZnSとは何ですか?
A: ZnS は、亜鉛と硫黄の化合物である硫化亜鉛の化学式です。
Q: ZnS の析出を防ぐために必要な最低 pH はどれくらいですか?
A: ZnS の析出を防ぐために必要な最小 pH は約 4.7 です。
Q: この画像は、ZnS の立方体単位胞を示しています。この立方体セルには Zn²⁺ イオンが何個ありますか?
A: ZnS の立方体セルには 4 つの Zn2+ イオンが存在します。
Q: ZnS はイオン性ですか、それとも共有結合性ですか?
A: ZnS は主にイオン性であると考えられています。
Q: Zn + S = ZnS とはどのような反応ですか?
A: Zn + S = ZnS という反応は合成または組み合わせ反応です。
