硝酸 (HNO3) は強力で反応性の高い無機酸です。肥料、爆薬、繊維の染色および印刷産業で使用されます。また、生物学的プロセスや燃焼反応において重要な役割を果たす硝酸塩も形成します。
| IUPAC名 | 硝酸 |
| 分子式 | HNO3 |
| CAS番号 | 7697-37-2 |
| 同義語 | アクアフォルティス、スピリットオブニトレ、亜硝酸 |
| インチチ | InChI=1S/HNO3/c2-1(3)4 |
硝酸の性質
硝酸モル質量
硝酸のモル質量は 63.01 g/mol です。これは、12 グラムの純粋な炭素 12 と同じ数の実体 (原子、分子、イオンなど) を含む物質の量です。
硝酸の計算式
硝酸の化学式は HNO<sub>3</sub> です。分子内の原子の数と種類を表します。この式を使用して、沸点、融点、密度などの物理的および化学的特性を予測できます。
硝酸の沸点
硝酸の沸点は 83.0°C (181.4°F) です。一定の圧力下で物質が液体から気体に変化する温度です。硝酸は反応性が高く揮発性の高い物質であり、沸点は硝酸の取り扱いおよび保管条件を決定するのに役立ちます。
硝酸の融点
硝酸の融点は -41.5°C (-42.7°F) です。固体物質が液体に状態を変化させる温度のことです。硝酸は融点が低いため、液体の状態での取り扱いが容易です。
硝酸の密度 g/ml
硝酸の密度は 1.51 g/mL です。物質の単位体積あたりの質量の尺度です。硝酸の密度は、硝酸の保管と取り扱いの要件、および他の物質と反応する可能性を決定するのに役立ちます。
硝酸の分子量
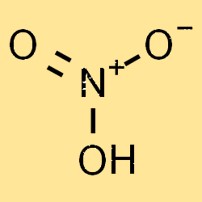
硝酸の分子量は 63.01 g/mol です。これは、分子内の個々の原子の原子量の合計です。硝酸の分子量は、その物理的および化学的特性を決定する重要な要素です。
硝酸の構造
硝酸は無色で、反応性が高く、揮発性の高い液体です。その分子構造は 1 つの窒素原子、1 つの水素原子、3 つの酸素原子で構成され、化学式 HNO3 を形成します。酸素原子は窒素原子の周りに三方晶系の平面配置で配置されています。
| 外観 | 無色の液体 |
| 比重 | 1.51g/ml |
| 色 | 無色 |
| 匂い | 刺激的な、刺激的な臭い |
| モル質量 | 63.01g/モル |
| 密度 | 1.51g/ml |
| 融合点 | -41.5°C (-42.7°F) |
| 沸点 | 83.0°C (181.4°F) |
| フラッシュドット | 適用できない |
| 水への溶解度 | 混和性 |
| 溶解性 | アルコール、エーテル、その他の極性溶媒に可溶 |
| 蒸気圧 | 室温で育てた |
| 蒸気密度 | 1.48 (空気 = 1) |
| pKa | -1.3 |
| pH | 1 (10% 溶液) |
注: 硝酸は液体であるため、引火点は適用されません。硝酸の 10% 溶液の pH は 1 であり、これは強酸であることを示します。 pKa は酸解離定数の負の対数であり、溶液中の酸の強度の尺度です。
硝酸の安全性と危険性
硝酸は反応性が高く腐食性の高い物質であり、適切に取り扱わないと重傷や死亡を引き起こす可能性があります。火傷、目の損傷、呼吸器への刺激を引き起こす可能性があります。硝酸を扱うときは、手袋やゴーグルなどの適切な保護具を着用してください。有毒ガスの放出を防ぐために、保管場所は十分に換気し、こぼれたものはすぐに掃除する必要があります。皮膚や目に入った場合は、患部を少なくとも 20 分間水で洗い流し、直ちに医師の診察を受けてください。
| ハザードシンボル | 環境に危険、酸化性、有害、刺激性 |
| セキュリティの説明 | S2 – 子供の手の届かないところに保管してください。 S23 – 煙を吸わないでください。 S24/25 – 皮膚や目との接触を避けてください。 S26 – 目に入った場合は、すぐに多量の水で洗い流し、医師の診察を受けてください。 |
| 国連識別番号 | 国連 2031 |
| HSコード | 2811.90.90 |
| 危険等級 | 8 |
| 梱包グループ | Ⅲ |
| 毒性 | 経口摂取および吸入すると非常に有毒です。重度の火傷や目の損傷、呼吸器への刺激を引き起こす可能性があります。 |
硝酸の合成法
硝酸は、次のようないくつかの方法で合成できます。
- オストワルド法: この方法では、アンモニアを空気で酸化して一酸化窒素を形成し、その後酸化して硝酸を生成します。
- トルエンのニトロ化: この方法では、トルエンをニトロ化してニトロトルエンを形成し、その後酸化して硝酸を形成します。
- 硝酸アンモニウムの熱分解: この方法では、硝酸アンモニウムを加熱して一酸化窒素を生成し、その後酸化して硝酸を生成します。
- アンモニアの直接酸化 : この方法では、アンモニアを酸素で直接酸化して硝酸を生成します。
- 硝酸ナトリウム電気分解: この方法では、硝酸ナトリウムを電気分解して硝酸を生成します。
これらの方法は、有効性、コスト、環境への影響が異なり、どの方法を選択するかは、目的の最終用途と生産規模によって異なります。
硝酸の用途
硝酸は、次のようなさまざまな産業で幅広い用途に使用されます。
- 肥料: 硝酸は、硝酸アンモニウムや硝酸塩などの窒素肥料の製造に使用されます。
- 医薬品: 硝酸は、医薬品やその他の化学中間体の製造における試薬として使用されます。
- 爆発物: 硝酸は、ダイナマイトやニトロセルロースなどの爆発物の製造に使用されます。
- 金属加工: 硝酸は、鋼、銅、アルミニウムなどの金属の酸洗い、洗浄、エッチングに使用されます。
- 染色および捺染: 染色および捺染工程で媒染剤として使用されます。
- 水処理: 水処理では、pH レベルを制御し、不純物を除去するために硝酸が使用されます。
- 研究開発: 硝酸は、さまざまな化学反応や分析のための実験用試薬として使用されます。
全体として、硝酸はその酸性および酸化特性により幅広い用途があり、さまざまな工業プロセスにおいて重要な化学物質となっています。
質問:
硝酸は強酸ですか、それとも弱酸ですか?
はい、硝酸 (HNO3) は強酸とみなされます。強酸は水中で完全に解離して水素イオン (H+) を生成します。つまり、完全にイオン化されます。対照的に、弱酸は水中では部分的にのみイオン化するため、完全には解離しません。
硝酸溶液では、ほぼすべての分子が水素イオンを供与しており、強力なプロトン供与体となります。その結果、硝酸は水素イオン濃度が高く、pH が低く、通常は約 1 ~ 2 になります。酸の強度は、水素イオンを供与する能力によって決まり、硝酸は強酸のリストの中で最も強い酸の 1 つです。
硝酸 (HNO3) は強い酸化作用があり、重度の火傷や化学反応を引き起こす危険があることに注意してください。硝酸は慎重に取り扱い、適切な保護具を着用してください。
