硝酸亜鉛 (Zn(NO3)2) は、亜鉛と硝酸イオンを含む化合物です。これは水溶性であり、触媒としてや染料や顔料の製造など、さまざまな用途に産業で一般的に使用されています。
| IUPAC名 | 硝酸亜鉛 |
| 分子式 | 亜鉛(NO3)2 |
| CAS番号 | 7779-88-6 |
| 同義語 | 二硝酸亜鉛、硝酸亜鉛塩、セロキサン、硝酸亜鉛 |
| インチチ | InChI=1S/2NO3.Zn/c2 2-1(3)4;/q2 -1;+2 |
硝酸亜鉛の性質
硝酸亜鉛配合
二硝酸亜鉛の式は Zn(NO3)2 です。これは、イオン結合によって結合された 1 つの亜鉛イオン (Zn2+) と 2 つの NO3- イオンで構成されます。式は化合物中に存在する元素の割合を表します。
硝酸亜鉛のモル質量
二硝酸亜鉛のモル質量は、その構成元素の原子質量を加算することで計算できます。亜鉛 (Zn) の原子量は 1 モルあたり約 65.38 グラム、NO3- イオンの窒素 (N) と酸素 (O) の原子量はそれぞれ 1 モルあたり約 14.01 グラムと 16.00 グラムです。したがって、二硝酸亜鉛のモル質量は 1 モルあたり約 189.38 グラムです。
硝酸亜鉛の沸点
二硝酸亜鉛は沸点に達する前に分解するため、特定の沸点がありません。しかし、加熱すると酸化亜鉛、二酸化窒素、酸素に分解します。この分解反応は約 140°C (284°F) で発生し、茶色の二酸化窒素フュームを放出します。
硝酸亜鉛の融点
二硝酸亜鉛の融点は、その水和状態によって異なります。無水形態の二硝酸亜鉛 (Zn(NO3)2) は約 238°C (460°F) で溶けます。ただし、六水和物 (Zn(NO3)2・6H2O) の結晶構造には水分子が含まれているため、融点は約 36°C (97°F) と低くなります。
硝酸亜鉛の密度 g/mL
二硝酸亜鉛の密度は、その濃度と温度によって変化します。ただし、標準条件下では、無水物の密度は約 2.065 グラム/ミリリットル (g/mL) です。六水和物の密度は、水分子の存在によりわずかに高くなります。
硝酸亜鉛の分子量
二硝酸亜鉛の分子量は、その構成元素の原子量を加算して計算されます。前述したように、二硝酸亜鉛の分子量は 1 モルあたり約 189.38 グラムです。
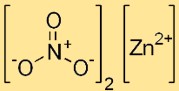
硝酸亜鉛の構造
二硝酸亜鉛はイオン構造をしており、亜鉛カチオン (Zn2+) が六水和物の形の 6 つの水分子に囲まれています。硝酸イオン (NO3-) は結晶格子内に個別の実体として存在します。
硝酸亜鉛の溶解度
二硝酸亜鉛は水によく溶けます。溶解度は温度とともに増加します。室温では、約 118 グラムの二硝酸亜鉛が 100 グラムの水に溶解し、飽和溶液が得られます。
| 外観 | 無色の結晶 |
| 比重 | 2,065g/ml |
| 色 | 無色 |
| 匂い | 無臭 |
| モル質量 | 189.38 g/モル |
| 密度 | 2,065g/ml |
| 融合点 | 238°C (460°F) (無水) |
| 沸点 | 分解します (~140°C/284°F) |
| フラッシュドット | 適用できない |
| 水への溶解度 | 水に非常に溶けやすい |
| 溶解性 | 水に溶ける |
| 蒸気圧 | 利用不可 |
| 蒸気密度 | 利用不可 |
| pKa | 適用できない |
| pH | ~4 (水溶液) |
硝酸亜鉛の安全性と危険性
硝酸亜鉛には、考慮する必要がある安全上のリスクがいくつかあります。潜在的なリスクを防ぐために、慎重に取り扱うことが重要です。化合物と接触すると、皮膚や目に炎症を引き起こす可能性があります。二硝酸亜鉛を摂取または吸入すると、胃腸障害や呼吸困難を引き起こす可能性があります。硝酸亜鉛を扱う場合は、手袋やゴーグルなどの適切な保護手段を使用することをお勧めします。さらに、不適合物質から離れた、換気の良い場所に保管する必要があります。誤って暴露または摂取した場合は、医師に相談することをお勧めします。適切な安全手順に従うことで、二硝酸亜鉛の安全な取り扱いと使用が保証されます。
| ハザードシンボル | 酸化剤 |
| セキュリティの説明 | 皮膚や目の炎症を引き起こします。摂取や吸入を避けてください。適切な保護措置を講じて取り扱ってください。 |
| 国連識別番号 | 国連番号1514(無水)、国連番号1515(六水和物) |
| HSコード | 28342990 |
| 危険等級 | 5.1 (酸化性物質) |
| 梱包グループ | II(無水)、III(六水和物) |
| 毒性 | 中程度の毒性 |
硝酸亜鉛の合成法
二硝酸亜鉛を合成するにはさまざまな方法があります。一般的なアプローチは、金属亜鉛と硝酸の反応です。この方法では、亜鉛が硝酸と反応して二硝酸亜鉛が生成され、水素ガスが発生します。オペレーターは安全性を維持するために反応を注意深く制御します。
別の方法には、酸化亜鉛と硝酸の反応が含まれます。酸化亜鉛は硝酸に溶解し、二硝酸亜鉛と水が生成します。この方法は、酸化亜鉛が容易に入手できる場合に役立ちます。
さらに、炭酸亜鉛は硝酸と反応して二硝酸亜鉛を生成します。炭酸塩は硝酸と反応して、二酸化炭素、水、二硝酸亜鉛を生成します。
これらの反応は、必要な安全対策を講じた適切な実験室条件下で実行する必要があることに注意することが重要です。手袋やゴーグルなどの適切な保護具を着用し、反応は換気の良い場所で実行する必要があります。
全体として、これらの方法は二硝酸亜鉛を合成する効率的な方法を提供し、さまざまな産業用途での使用を可能にします。
硝酸亜鉛の用途
二硝酸亜鉛は、その多用途な特性により、さまざまな産業で応用されています。二硝酸亜鉛の主な用途をいくつか紹介します。
- 触媒: 二硝酸亜鉛はさまざまな化学反応を触媒し、染料、医薬品、ポリマーの製造を促進します。
- 電気めっき: 電気めっきプロセスでは、二硝酸亜鉛が金属表面に亜鉛の層を堆積させ、耐食性を付与し、外観を改善します。
- 顔料と染料: 二硝酸亜鉛は、塗料、コーティング、繊維製品に不可欠な亜鉛ベースの顔料と染料の製造の前駆体として機能します。
- 肥料: 二硝酸亜鉛は肥料中の亜鉛源として機能し、植物が成長と発育に十分な栄養素を確実に受け取れるようにします。
- ガラス製造: 二硝酸亜鉛はガラス製造において重要な役割を果たし、透明性や屈折率などの光学特性を向上させます。
- 水処理: 硝酸亜鉛は水処理システムにおいて重要な役割を果たし、藻類や細菌の増殖を抑制し、水質を維持します。
- 実験室用試薬: さまざまな実験室での実験において、特に分析化学や研究において、二硝酸亜鉛は試薬として積極的に機能します。
- 医学および医薬品: 二硝酸亜鉛は、その抗菌特性により、特定の医薬品製剤や局所薬に積極的に貢献しています。
- 難燃剤: 二硝酸亜鉛は難燃剤配合の重要な成分であり、材料の可燃性を積極的に低減します。
- 繊維産業: 繊維の染色および印刷プロセスでは、二硝酸亜鉛が積極的に色堅牢度を向上させ、染料の吸収を改善します。
これらの多様な用途は、複数の業界にわたる二硝酸亜鉛の重要性を浮き彫りにし、さまざまな製品やプロセスに貢献しています。
質問:
Q: 硝酸亜鉛は水溶性ですか?
A: はい、二硝酸亜鉛は水溶性です。
Q: 硝酸亜鉛から炭酸亜鉛を沈殿させるにはどうすればよいですか?
A: Zn(NO3)2 から炭酸亜鉛を沈殿させるには、炭酸ナトリウムまたは重炭酸ナトリウム溶液を二硝酸亜鉛溶液に加えます。その結果、沈殿物として炭酸亜鉛が形成されます。
Q: 亜鉛は硝酸銀と反応しますか?
A: はい、Zn は硝酸銀と反応し、金属銀を置き換えて二硝酸亜鉛を形成します。
Q: 硝酸亜鉛は塩ですか?
A: はい、硝酸亜鉛は亜鉛カチオン (Zn2+) と NO3- イオンから構成される塩です。
Q: 硝酸亜鉛が水酸化カリウムと反応すると何が形成されますか?
A: Zn(NO3)2 が水酸化カリウムと反応すると、Zn(OH)2 が沈殿し、硝酸カリウムが形成されます。
Q: 硝酸亜鉛リチウムの式は何ですか?
A: 二硝酸亜鉛リチウムの化学式は、LiZn(NO3)3 です。
Q: 硝酸マグネシウムと硝酸亜鉛溶液を標準化するにはどうすればよいですか?
A: 硝酸マグネシウムおよび二硝酸亜鉛溶液を標準化するには、適切な標準化試薬を使用した滴定法を使用できます。
Q: 硝酸亜鉛の製造に使用される酸と金属酸化物は何ですか?
A: 二硝酸亜鉛の製造には、硝酸 (HNO3) と酸化亜鉛 (ZnO) が使用されます。
Q: 亜鉛を硝酸鉛溶液に添加すると、どのような生成物が生成されますか?
A: 硝酸鉛の溶液に亜鉛を添加すると、二硝酸亜鉛と金属鉛が生成します。
Q: 硝酸亜鉛とは何ですか?
A: 二硝酸亜鉛は、亜鉛カチオン (Zn2+) と NO3- アニオンで構成される化合物で、多くの場合結晶固体として見られます。
Q: 1.50 モルの Zn(NO3)2 には酸素原子が何個ありますか?
A: 1.50 モルの Zn(NO3)2 には、9.00 モル、つまり 27.00 個の酸素原子が存在します。
Q: 97 ppm Zn2+(aq) を調製するには、どの質量の Zn(NO3)2 を H2O で 1.00 kg の質量に希釈する必要がありますか?
A: 97 ppm Zn2+(aq) を含む溶液を調製するには、約 97 mg の Zn(NO3)2 を水で 1.00 kg の質量に希釈する必要があります。
