硝酸リチウム (LiNO₃) は、さまざまな用途に使用される化合物です。水溶性やセラミックやガラスの製造における役割など、独特の特性を示します。
| IUPAC名 | 硝酸リチウム |
| 分子式 | LiNO₃ |
| CAS番号 | 7790-69-4 |
| 同義語 | 硝酸リチウム、硝酸リチウム塩、硝酸リチウム(I) |
| インチー | InChI=1S/Li.NO3/c;2-1(3)4/q+1;-1 |
硝酸リチウムの性質
硝酸リチウムの配合
硝酸のリチウム塩の化学式は LiNO3 です。 1 つのリチウム (Li)、1 つの窒素 (N) 原子、3 つの酸素 (O) 原子で構成されています。この化学式は、化合物内の各元素の組成を表します。
硝酸リチウムのモル質量
硝酸のリチウム塩のモル質量は約 68.95 g/mol です。モル質量は物質 1 モルの質量を指し、式内のすべての原子の原子質量を加算することによって計算されます。
硝酸リチウムの沸点
硝酸のリチウム塩の沸点は約 600°C (1112°F) です。沸点は、標準大気圧下で物質が液体から気体に変化する温度です。
硝酸リチウムの融点
硝酸のリチウム塩の融点は約 255°C (491°F) です。融点は、標準大気圧下で物質が固体から液体に変化する温度です。
硝酸リチウムの密度 g/mL
硝酸のリチウム塩の密度は約 2.38 g/mL です。密度は単位体積あたりの物質の質量を表し、その物理的挙動を理解するための重要な特性です。
硝酸リチウムの分子量
硝酸のリチウム塩の分子量は 68.95 g/mol です。分子量は、分子内のすべての原子の原子量の合計であり、モルあたりのグラム数で表されます。
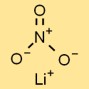
硝酸リチウムの構造
硝酸のリチウム塩はイオン性の結晶構造を持ち、リチウムカチオン (Li+) と硝酸アニオン (NO3-) が規則的な繰り返しパターンを形成します。この構造は、その安定性と特性に貢献します。
硝酸リチウムの溶解度
硝酸のリチウム塩は水によく溶けます。この高い溶解性はその重要な特性の 1 つであり、セラミックやガラスの製造などのさまざまな用途に役立ちます。
| 外観 | 白色固体 |
| 比重 | 該当なし |
| 色 | 白 |
| 匂い | 無臭 |
| モル質量 | 68.95g/モル |
| 密度 | 2.38g/ml |
| 融合点 | 255°C (491°F) |
| 沸点 | 600°C (1112°F) |
| フラッシュドット | 該当なし |
| 水への溶解度 | 非常に溶けやすい |
| 溶解性 | 水およびエタノールなどの有機溶媒に可溶 |
| 蒸気圧 | 該当なし |
| 蒸気密度 | 該当なし |
| pKa | 該当なし |
| pH | 該当なし |
一部の特性は適用できない(N/A)場合や、硝酸リチウムに関して利用可能なデータが限られている場合があることに注意してください。
硝酸リチウムの安全性と危険性
硝酸のリチウム塩には、安全性と危険性に関する考慮事項がいくつかあります。接触または吸入すると、皮膚、目、気道を刺激することがあります。取り扱う際には、手袋や安全メガネなどの適切な保護具を使用することが不可欠です。胃腸の不快感を引き起こす可能性があるため、摂取を避けてください。危険な反応を避けるため、混入しない物質から遠ざけて保管してください。こぼれや漏れが発生した場合は、直ちに封じ込めて洗浄してください。さらに、常に適切な保管ガイドラインに従い、安全で換気の良い場所に保管してください。安全な取り扱いを優先し、関連する安全プロトコルに従って、硝酸リチウム塩に関連するリスクを最小限に抑えてください。
| ハザードシンボル | 警告 |
| セキュリティの説明 | – 皮膚、目、気道を刺激します。 – 摂取を避けてください。 – 保護具を使用してください。 – 換気の良い場所に保管してください。 |
| 国連識別番号 | UN1477 |
| HSコード | 28342990 |
| 危険等級 | 5.1 (酸化剤) |
| 梱包グループ | Ⅱ |
| 毒性 | 毒性は低いですが、慎重に取り扱い、適切な安全対策を講じる必要があります。 |
特定の危険記号および安全上の推奨事項は、管轄区域および規制によって異なる場合があることに注意してください。硝酸リチウム塩を取り扱う場合は、必ず適切な安全データシートと地域の安全ガイドラインを参照してください。
硝酸リチウムの合成法
硝酸のリチウム塩を合成するにはいくつかの方法があります。
一般的なアプローチには、炭酸リチウム (Li2CO3) と硝酸 (HNO3)の反応が含まれます。このプロセス中に、2 つの化合物が反応して、副生成物として硝酸のリチウム塩と水 (H2O) が生成されます。この反応の化学式は次のとおりです。
Li₂CO₃ + 2HNO₃ → 2LiNO₃ + H₂O
別の方法は、水酸化リチウム(LiOH)と硝酸を反応させて、硝酸と水のリチウム塩を得る方法です。反応式は次のとおりです。
LiOH + HNO₃ → LiNO₃ + H₂O
硝酸のリチウム塩は、硝酸を酸化リチウム(Li2O)または炭酸リチウムで中和することによって形成されます。方程式は次のとおりです。
Li₂O + 2HNO₃ → 2LiNO₃ + H₂O Li₂CO₃ + 2HNO₃ → 2LiNO₃ + CO₂ + H₂O
これらのすべての方法において、試薬と生成物は反応性があり、潜在的な危険性があるため、慎重に取り扱うことが重要です。硝酸リチウム塩の製造を確実に成功させるには、合成プロセス中に適切な安全対策と制御された条件が不可欠です。
硝酸リチウムの用途
硝酸のリチウム塩は、そのユニークな特性によりさまざまな用途に使用されます。その用途は次のとおりです。
- 空気処理: 硝酸リチウム塩は空気処理用途で乾燥剤として機能し、空気から水分を除去して腐食を防ぎ、最適な環境条件を維持します。
- 化学合成における試薬: さまざまな化学反応において硝酸イオンの供給源として機能し、他の化合物や物質の合成に役立ちます。
- 特殊化学薬品: 触媒や腐食防止剤などの特殊化学薬品の製造に応用されます。
- 花火と花火: 硝酸のリチウム塩は花火の酸化剤として重要な役割を果たし、花火の鮮やかな赤色に寄与します。
- 製薬産業: 製薬産業では、化学合成および特定の医薬品製剤の研究における試薬として硝酸リチウム塩が使用されています。
- リチウム電池: 電池には直接使用されませんが、硝酸のリチウム塩はリチウムイオン電池産業に関連しています。メーカーは、これらの電池で使用される電解質に硝酸のリチウム塩から得られるリチウム塩を組み込んでいます。
- 原子炉: 一部の種類の原子炉では、中性子吸収特性があるため、冷却剤として硝酸リチウム塩が使用されます。
- セラミックおよびガラスの製造: セラミックおよびガラスの製造プロセスでは、硝酸のリチウム塩がフラックス剤として機能します。材料の融点を効果的に下げ、作業性と製品品質を向上させます。
- 熱伝達流体: 硝酸リチウム塩は、水への溶解度が高いため、熱伝達流体、特に太陽エネルギーシステムに応用されています。効率的な熱交換を促進し、熱エネルギーを蓄えることができます。
質問:
Q: 硝酸リチウム、LiNO₃ の分子には合計何個の原子が含まれていますか?
A: 硝酸リチウム塩の分子には、リチウム原子 (Li) 1 個、窒素原子 (N) 1 個、酸素原子 (O) 3 個の 5 つの原子があります。
Q: 硝酸銅(II)六水和物とクロム酸リチウム二水和物の正しい式は何ですか?
A: 正しい式は、硝酸銅(II)六水和物はCu(NO3)₂・6H₂O、クロム酸リチウム二水和物はLi₂CrO4・2H₂Oです。
Q: 250 ml の 0.5 M 溶液を調製するには、何グラムの硝酸リチウムが必要ですか?
A: 0.5 M 溶液 250 ml を調製するには、17.24 グラムの硝酸リチウム塩が必要です。
Q: 硝酸リチウムはイオン性ですか、それとも共有結合性ですか?
A: 硝酸のリチウム塩はイオン性化合物です。
Q: LiNO₃ は水に溶けますか?
A: はい、硝酸リチウム (LiNO₃) は水に溶けます。
Q: 平衡方程式では、LiNO₃ の前にどの係数を入力する必要がありますか?
A: 係数「2」は平衡式の LiNO₃ の前に現れる必要があります。
Q: 次の化合物のうち、水に溶ける化合物はいくつありますか? Pb(OH)₂、LiNO₃、NH₄Br、K₂S
A: LiNO3、NH4Br、K2S の 3 つの化合物は水溶性です。
Q: LiNO₃ は可溶ですか?
A: はい、LiNO₃ は可溶です。
Q: LiNO₃ は水性ですか、それとも固体ですか?
A: LiNO₃ は水に溶解すると水性になります。
Q: LiNO₃ は酸性、塩基性、または中性ですか?
A: 硝酸リチウム塩 (LiNO₃) は中性の化合物です。
Q: 硝酸リチウム、LiNO₃ の分子には合計何個の原子が含まれていますか?
A: 硝酸リチウムの分子には 5 つの原子があります: 1 つのリチウム (Li) 原子、1 つの窒素 (N) 原子、および 3 つの酸素 (O) 原子です。
Q: LiNO₃ はイオン性ですか、それとも共有結合性ですか?
A: LiNO3 はイオン性化合物です。
