硝酸カルシウムは、化学式 Ca(NO3)2 で表される化合物です。無色無臭の固体で、水によく溶けます。硝酸カルシウムは肥料や廃水処理に一般的に使用されます。また、コンクリートの製造、爆薬の成分として、および他のさまざまな化学物質の製造にも使用されます。
| IUPAC名 | 二硝酸カルシウム |
| 分子式 | Ca(NO3)2 |
| CAS番号 | 10124-37-5 |
| 同義語 | 硝酸カルシウム四水和物、硝酸カルシウム塩、亜硝酸塩、ノルウェー硝石、石灰硝石、ノルゲサル硝石 |
| インチチ | InChI=1S/Ca.2NO3/c;22-1(3)4/q+2;2-1 |
硝酸カルシウムの配合
硝酸カルシウムの式は Ca(NO3)2 です。これは、硝酸カルシウムの各単位には 1 つのカルシウムイオン (Ca2⁺) と 2 つの硝酸イオン (NO3⁻) が含まれていることを意味します。硝酸カルシウムの式は、化合物のモル質量やその他の特性を決定するためによく使用されます。
硝酸カルシウムのモル質量
硝酸カルシウムのモル質量は 164,088 g/mol です。これは、Ca+2 イオンと NO3- イオンで構成される塩で、式は Ca(NO3)2 です。化合物のモル質量は、その式化合物の 1 モルのグラム単位の質量であり、その重量に等しい。 Ca(NO3)2 の場合、式量は化合物内のすべての原子の原子量の合計です。
硝酸カルシウムの沸点
Ca(NO3)2 の沸点は 132 ℃と比較的高くなります。これは、固体化合物を気体に変換するにはかなりの量のエネルギーが必要であることを意味します。 Ca(NO3)2 の沸点が高いのはそのイオン性によるもので、Ca+2 イオンと NO3- イオンの間に強い静電相互作用が生じます。
硝酸カルシウムの融点
Ca(NO3)2 の融点は摂氏 561 度です。これは塩としては比較的高く、ここでも Ca+2 イオンと NO3- イオン間の強いイオン相互作用を反映しています。 Ca(NO3)2 は融点が高いため、肥料や爆薬の製造などの高温用途に有用な化合物です。
硝酸カルシウムの密度 g/ml
Ca(NO3)2は形状により密度が異なります。たとえば、無水 Ca(NO3)2 の密度は約 2.5 g/cm3 ですが、四水和物 (Ca(NO3)2.4H2O) の密度は約 1.82 g/cm3 です。これらの値により、Ca(NO3)2 は他の多くの塩と比較して比較的高密度の化合物になります。
硝酸カルシウムの分子量
Ca(NO3)2 の分子量は 164.088 g/mol です。この値は、化合物内のすべての原子の原子量の合計であり、2 つの窒素原子、6 つの酸素原子、および 1 つのカルシウム原子が含まれます。
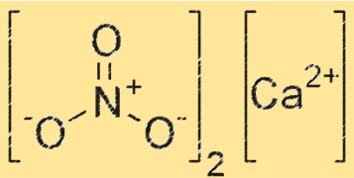
硝酸カルシウムの構造
Ca(NO3)2 はイオン構造を持ち、カルシウム イオン (Ca2+) が 6 つの酸素原子に囲まれて八面体配置になっています。 NO3- イオンも結晶格子内に存在し、NO3- イオンの各酸素原子は Ca+2 イオンと配位結合を形成します。 Ca(NO3)2 の構造は、塩化ナトリウムなどの他のイオン性化合物の構造と似ています。
| 外観 | 白色の結晶または粉末 |
| 比重 | 2.5 (無水); 1.82(四水和物) |
| 色 | 無色(無水)。白色(四水和物) |
| 匂い | 無臭 |
| モル質量 | 164,088 g/モル |
| 密度 | 2.5 g/cm3 (無水); 1.82 g/cm3 (四水和物) |
| 融合点 | 561℃ (無水); 45℃(四水和物) |
| 沸点 | 132℃(分解) |
| フラッシュドット | 適用できない |
| 水への溶解度 | 121.2g/100ml (0℃); 126.7g/100ml (20℃); 179.6g/100ml(100℃) |
| 溶解性 | 水、エタノール、メタノールに可溶 |
| 蒸気圧 | 無視できるほど(無水) |
| 蒸気密度 | 適用できない |
| pKa | 適用できない |
| pH | 4.5-7.5 (10%溶液) |
硝酸カルシウムの安全性と危険性
硝酸カルシウム (Ca(NO3)2) は、適切に取り扱わないと、いくつかの危険を引き起こす可能性があります。強力な酸化剤であり、可燃物と接触すると火災や爆発を引き起こす可能性があります。また、この化合物は接触すると皮膚や目に炎症を引き起こす可能性があり、粉塵を吸入すると気道に炎症を引き起こす可能性があります。 Ca(NO3)2 は、熱源から離れた涼しく乾燥した場所に保管する必要があり、適切な予防措置を講じずに他の化学物質と混合しないでください。 Ca(NO3)2 を取り扱うときは、皮膚や目との接触を避けるため、手袋や保護眼鏡などの個人用保護具を着用する必要があります。誤って摂取した場合は、直ちに医師の診察を受けてください。
| ハザードシンボル | 酸化剤(GHS05)、刺激剤(GHS07) |
| セキュリティの説明 | S22: 粉塵/煙霧/ガス/ミスト/蒸気/エアロゾルを吸い込まないでください。 S26: 目に入った場合は、直ちに多量の水で洗い流し、医師の診察を受けてください。 S36/37/39: 適切な保護服、手袋、目/顔の保護具を着用してください。 |
| AN識別子 | UN1454(無水硝酸カルシウム)、UN1455(硝酸カルシウム四水和物) |
| HSコード | 283429 |
| 危険等級 | 5.1 (酸化剤) |
| 梱包グループ | Ⅲ |
| 毒性 | 経口 (LD50): 3,420 mg/kg (ラット);経皮 (LD50): > 5,000 mg/kg (ウサギ)。吸入 (LC50): >4.8 mg/l/4h (ラット) |
硝酸カルシウムの合成法
Ca(NO3)2 を合成するには、特定の用途と必要な純度に応じてさまざまな方法があります。
一般的な方法は、炭酸カルシウムと硝酸を反応させて Ca(NO3)2 と二酸化炭素を生成することです。
CaCO3 + 2HNO3 → Ca(NO3)2 + CO2 + H2O
別の方法は、水酸化カルシウムと硝酸を反応させることです。
Ca(OH)2 + 2HNO3 → Ca(NO3)2 + 2H2O
硝酸と酸化カルシウムの反応により、Ca(NO3)2 が得られます。
CaO + 2HNO3 → Ca(NO3)2 + H2O
得られた Ca(NO3)2 は、再結晶または少量の硫酸を添加して鉄やアルミニウムなどの不純物を除去することによってさらに精製できます。
メーカーは、金属カルシウムと硝酸を反応させるか、水酸化カルシウムと硝酸アンモニウムを反応させることによって、Ca(NO3)2 を生成できます。ただし、反応性金属や硝酸アンモニウムに関連するコストや安全性の懸念から、これらの方法はあまり一般的ではありません。
硝酸カルシウムの用途
- 農業において肥料として使用され、植物の成長に必要なカルシウムと窒素の栄養素を提供します。
- 強度と耐久性を向上させるために、数種類のコンクリートやセメントの成分として使用されます。
- 廃水処理化学物質の製造における添加剤として使用され、水からリンおよび窒素化合物を除去するのに役立ちます。
- 酸化特性があるため、数種類の爆薬や花火の製造に使用されます。
- ナイロンやその他の合成繊維などのさまざまな化学薬品の製造において、カルシウムと窒素の供給源として使用されます。
- 産業用途では、アルミニウムや鋼などの金属の腐食防止剤として使用されます。
- 肉の保存や特定の食品の品質を向上させるための食品添加物として使用されます。
- 軍事および民間用途の発煙弾や発煙筒の製造に使用されます。
- 特定の肥料の製造に使用されます。作物にバランスのとれた栄養素を供給するために、他の化合物と組み合わせて使用することもできます。
- 水生植物に必須の栄養素を提供するために、一部の特殊な水族館用肥料の成分として使用されます。
質問:
Q: Ca(NO3)2 の名前は何ですか?
A: Ca(NO3)2 の名前は硝酸カルシウムです。
Q: Ca(NO3)2 は水に溶けますか?
A: はい、Ca(NO3)2 は水によく溶けます。室温では、100 グラムの水に最大 121 グラムの硝酸カルシウムが溶解します。
Q: 硝酸カルシウムはどこで買えますか?
A: Ca(NO3)2 は、さまざまな化学物質の供給業者からオンラインおよび店舗で購入できます。 Ca(NO3)2 を購入する一般的な場所には、科学用品会社、農産物店、ホームセンターや園芸センターなどがあります。サプライヤーが信頼できるものであり、製品が高品質で意図された用途に適していることを確認することが重要です。
