炭酸カリウム (K2CO3) は、石鹸、ガラス、セラミックスの製造に一般的に使用される白色の無臭の粉末です。また、食品添加物や製薬業界の緩衝剤としても使用できます。
| IUPACの名称 | 炭酸カリウム |
| 分子式 | K2CO3 |
| CAS番号 | 584-08-7 |
| 同義語 | 炭酸、二カリウム塩;パールアッシュ;カリ;酒石の塩。一炭酸カリウム;炭酸水素カリウム |
| インチチ | InChI=1S/CH2O3.2K/c2-1(3)4;;/h(H2,2,3,4);;/q;2*+1/p-2/fCO3.2K/q-2;メートル |
炭酸カリウムの性質
炭酸カリウムの配合
炭酸カリウムの化学式はK2CO3です。この式は、化合物内の各元素の正確な原子数を表します。この式を使用して、化合物のモル質量およびその他の特性を計算できます。
炭酸カリウムのモル質量
K2CO3 のモル質量は 138.21 g/mol です。これは、1 モルの K2CO3 に 138.21 グラムの化合物が含まれていることを意味します。モル質量は、特定の反応または実験に必要な物質の量を決定する際に重要です。物質の質量をモルに変換するためにも使用されます。
炭酸カリウムの沸点
K2CO3 は 1,620 °C (2,948 °F) と比較的高い沸点を持っています。これにより、ガラスやセラミックの製造などの高温用途に役立ちます。沸点とは、物質が液体から気体に変化する温度です。
炭酸カリウムの融点
K2CO3 の融点は 891°C (1,636°F) です。この比較的高い融点は、化合物のイオン性によるものです。加熱すると、物質が溶けるには、カリウムイオンと炭酸イオンの間のイオン結合が切断される必要があります。
炭酸カリウムの密度 g/mL
K2CO3 の密度は室温で 2.43 g/mL です。これは、特定の体積の K2CO3 が特定の質量を持つことを意味します。物質の密度は、物質を識別し、特定の空間内の物質の質量または体積を計算するために使用できる重要な特性です。
炭酸カリウムの分子量
K2CO3 の分子量は 138.21 g/mol です。これは化合物の 1 モルの質量であり、多くの化学計算において重要です。
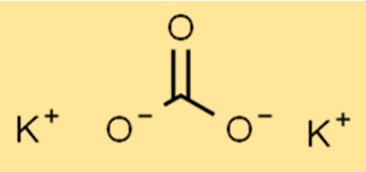
炭酸カリウムの構造
K2CO3 はイオン構造を持ち、式は K2CO3 です。カリウムイオン(K+)と炭酸イオン(CO32-)はイオン結合によって結合しています。炭酸イオンは、1 つの炭素原子と 3 つの酸素原子で構成される多原子イオンです。
| 外観 | 白色の結晶性粉末 |
| 比重 | 2.43 |
| 色 | 白 |
| 匂い | 無臭 |
| モル質量 | 138.21 g/モル |
| 密度 | 2.43g/ml |
| 融合点 | 891°C (1,636°F) |
| 沸点 | 1620°C (2948°F) |
| フラッシュドット | 適用できない |
| 水への溶解度 | 112 g/100 mL(20℃) |
| 溶解性 | 水、グリセロール、アルコールに可溶 |
| 蒸気圧 | 室温では無視できる |
| 蒸気密度 | 適用できない |
| pKa | 午前10時33分 |
| pH | 11.5 (10 g/Lの水溶液) |
炭酸カリウムの安全性と危険性
K2CO3 は一般に、産業製品や家庭用製品での使用が安全であると考えられています。ただし、皮膚や目を刺激する可能性があり、粉末を吸入すると気道への炎症を引き起こす可能性があります。高濃度の K2CO3 粉塵に長時間さらされると、肺に損傷を与える可能性があります。この化合物を取り扱うときは、手袋、ゴーグル、マスクなどの適切な個人用保護具を着用することが重要です。 K2CO3 は可燃性でも爆発性でもありませんが、酸と反応して二酸化炭素を生成する可能性があり、密閉空間では危険な場合があります。飲み込んだ場合、または皮膚や目に接触した場合は、直ちに医師の診察を受けてください。
| ハザードシンボル | なし |
| セキュリティの説明 | 手袋、ゴーグル、マスクを着用してください。皮膚や目との長時間の接触を避けてください。粉末を吸入しないでください。 |
| 国連識別番号 | UN1863 |
| HSコード | 2836.40.00 |
| 危険等級 | 危険ではありません |
| 梱包グループ | 適用できない |
| 毒性 | 炭酸カリウムは有毒とは考えられていませんが、高濃度では呼吸器官や皮膚の炎症を引き起こす可能性があります。高濃度の粉塵に長時間さらされると、肺に損傷を与える可能性があります。 |
炭酸カリウムの合成法
K2CO3はさまざまな方法で合成できます
一般的な方法は、水酸化カリウムと二酸化炭素を反応させることです。
二酸化炭素の流出を防ぐため、この反応は密閉容器内で行うことができます。
別の方法には、水溶液中で塩化カリウムと炭酸ナトリウムを反応させることが含まれる。結果として生じる K2CO3 は溶液から沈殿し、濾過によって収集できます。
K2CO3 を合成する別の方法は、木炭の存在下で硫酸カリウムを炭素と反応させることです。歴史的に、化学者は工業規模で K2CO3 を製造するためにルブラン法を使用していました。しかし、環境への懸念により、二酸化硫黄が放出されるため、このプロセスは現在ではまれになっています。
K2CO3 は、重炭酸カリウムを高温に加熱して K2CO3 と二酸化炭素に分解することで合成できます。この反応はオーブンまたはオーブンで実行できます。
炭酸カリウムの用途
K2CO3 は、そのユニークな特性により、さまざまな産業で幅広い用途に使用されています。一般的な用途には次のようなものがあります。
- ガラスの製造: シリカやその他の成分の融点を下げるためのフラックスとして使用されます。
- 食品産業: 酸度を調整するための食品添加物として、またベーキング時の脱離剤として使用されます。
- 石鹸と洗剤: 軟水剤として石鹸や洗剤の製造にも使用されます。
- 製薬産業: 医薬品製剤の緩衝剤として使用されます。
- 肥料: 農業において植物にカリウムを供給する肥料としても使用されます。
- セラミック製造: 焼成温度を下げ、最終製品の品質を向上させるためのフラックスとして使用されます。
- 花火: 紫色の炎を発生させる花火の製造に使用されます。
- 電池: 電池の製造に電解液として使用されます。
- 繊維産業:染色剤として使用されます。
質問:
Q: 炭酸カリウムは溶けますか?
A: はい、炭酸カリウムは水に溶けます。
Q: K2CO3 は水に溶けますか?
A: はい、K2CO3 は水に溶けます。実際、それは非常に溶解性が高く、水に溶解して無色透明の溶液を形成することができます。
Q: 2.5 M 溶液 200 ml を調製するには、何グラムの炭酸カリウムが必要ですか?
A: 200 ml の水に 2.5 M K2CO3 を溶かした溶液を調製するには、33.25 グラムの K2CO3 を水に溶かす必要があります。
計算: モル濃度 = モル / 体積 (リットル) 2.5 M = モル / 0.2 L モル = 0.5 モル質量 = モル x モル質量 質量 = 0.5 モル x 138.21 g/モル質量 = 33.25g
Q: 完全に解離すると仮定した場合、0.045 M K2CO3 溶液中の K イオンの濃度はどれくらいですか?
A: K2CO3 が水中で完全に解離すると、2 つの K+ イオンと 1 つの CO3 2- イオンが形成されます。したがって、0.045 M K2CO3 溶液中の K+ イオンの濃度は、K2CO3 溶液のモル濃度である 0.090 M の 2 倍になります。
