水酸化鉄(III)は、鉄と水の反応によって形成される化合物です。医薬品、水処理、塗料の顔料として一般的に使用されています。
| IUPAC名 | 水酸化鉄(III) |
| 分子式 | Fe(OH)₃ |
| CAS番号 | 20344-49-4 |
| 同義語 | 水酸化第二鉄、三水酸化鉄、水酸化第二鉄、オキシ水酸化鉄(III) |
| インチチ | InChI=1S/Fe.3H2O/h;3*1H2/q+3;;;/p-3 |
水酸化鉄(III)の性質
水酸化鉄(III)の式
水酸化鉄(III)の式はFe(OH)3です。これは、各 Fe(OH)3 分子が 3 つの OH イオンに結合した 1 つの Fe 原子から構成されていることを示しています。
水酸化鉄(III) モル質量
Fe(OH)3 のモル質量は、その構成元素の原子質量を加算することで計算できます。鉄のモル質量は 55.845 g/mol、各水酸化物 (OH) イオンのモル質量は 17.007 g/mol です。したがって、Fe(OH)3 のモル質量は約 106.867 g/mol です。
水酸化鉄(III)の沸点
Fe(OH)₃ は沸点に達する前に分解するため、明確に定義された沸点がありません。代わりに、加熱すると熱分解が起こり、酸化鉄(III)と水が生成されます。
水酸化鉄(III)の融点
Fe(OH)₃ も加熱すると分解し、明確な融点はありません。高温になると酸化鉄(III)と水に変化します。
水酸化鉄(III)の密度 g/mL
Fe(OH)₃ の密度は、その物理的状態 (固体または溶液) や濃度などのさまざまな要因に依存します。 Fe(OH)3 の固体形態の密度は約 3.4 g/mL です。
水酸化鉄(III)の分子量
Fe(OH)3 の分子量は、その構成原子の原子量を加算することによって計算されます。 Fe(OH)3 の分子量は約 106.867 g/mol です。
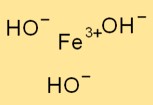
水酸化鉄(III)の構造
Fe(OH)₃ は三方晶系構造をとり、鉄原子が 3 つの水酸化物イオンに囲まれています。鉄原子が中心原子として機能し、水酸化物イオンがイオン結合によって鉄原子に結合します。
水酸化鉄(III)の溶解度
Fe(OH)₃ の水への溶解度は限られています。水に溶解すると沈殿を形成し、その溶解度は温度、pH、他のイオンの存在などのさまざまな要因に依存します。 Fe(OH)3 の溶解度は酸性条件下で増加します。
| 外観 | ソリッドブラウン |
| 比重 | 3.4 |
| 色 | 茶色 |
| 匂い | 無臭 |
| モル質量 | 106,867 g/モル |
| 密度 | 3.4g/ml |
| 融合点 | 分解された |
| 沸点 | 分解された |
| フラッシュドット | 適用できない |
| 水への溶解度 | 不溶性 |
| 溶解性 | 不溶性。温度、pH、他のイオンの存在などの要因に依存します |
| 蒸気圧 | 無視できる |
| 蒸気密度 | 適用できない |
| pKa | 適用できない |
| pH | 5~7くらい |
水酸化鉄(III)の安全性と危険性
Fe(OH)₃ には、安全上の考慮事項と危険性が伴います。一般に毒性は低いと考えられています。ただし、大量に摂取または吸入すると、胃腸の炎症や呼吸器の不快感を引き起こす可能性があります。刺激を引き起こす可能性があるため、目や皮膚との接触を避けることが重要です。目に入った場合は、患部を多量の水で洗い流してください。 Fe(OH)₃ を取り扱う場合は、暴露のリスクを最小限に抑えるために、手袋やゴーグルなどの適切な保護具を着用することをお勧めします。粉塵の蓄積を避けるために、適切な換気を確保する必要があります。さらに、潜在的なリスクを最小限に抑えるために、安全上の注意事項に従い、Fe(OH)₃ を慎重に取り扱うことが不可欠です。
| ハザードシンボル | なし |
| セキュリティの説明 | – 目や皮膚との接触を避ける <br> – 保護具を着用 <br> – 適切な換気を確保する |
| 国連識別番号 | 適用できない |
| HSコード | 2821.10.0000 |
| 危険等級 | 未分類 |
| 梱包グループ | 適用できない |
| 毒性 | 低毒性 |
水酸化鉄(III)の合成方法
Fe(OH)₃ を合成するにはさまざまな方法があります。一般的に使用される方法には、鉄塩と塩基の間の沈殿反応が含まれます。たとえば、塩化鉄 (FeCl3)の溶液を水酸化ナトリウム (NaOH)の溶液に添加すると、Fe(OH)3 が形成されます。反応は次のように起こります。
FeCl₃ + 3NaOH → Fe(OH)₃ + 3NaCl
別の方法では、水酸化鉄(II)を空気にさらすか酸化剤で処理することにより、水酸化鉄(II)をFe(OH)3に酸化することができます。反応は次のように起こります。
4Fe(OH)₂ + O₂ → 2Fe(OH)₃
さらに、Fe(OH)3 は鉄塩溶液を加水分解することによって調製できます。このプロセスには、鉄塩溶液に水を加えることが含まれ、その結果、Fe(OH)3 の沈殿物が形成されます。反応は次のように起こります。
FeCl₃ + 3H₂O → Fe(OH)₃ + 3HCl
これらの合成方法は、医薬品、水処理、塗料の顔料などのさまざまな用途に Fe(OH)₃ を得る方法を提供します。適切な安全上の注意事項に従い、合成プロセス中に化学物質を責任を持って取り扱うことが重要です。
水酸化鉄(III)の用途
Fe(OH)₃ はその独特の特性により、いくつかの用途があります。 Fe(OH)₃ の一般的な用途をいくつか示します。
- 製薬産業: 製薬産業は、鉄欠乏性貧血の治療に使用される鉄サプリメントや医薬品などの製造に Fe(OH)₃ を使用します。
- 水処理: 水処理プロセスでは、Fe(OH)₃ を使用して汚染物質や不純物を除去します。 Fe(OH)₃ は凝集剤として作用し、水中の浮遊粒子を凝集させて除去するのに役立ちます。
- 塗料中の顔料: Fe(OH)₃ は茶色で、塗料、コーティング、染料の顔料として使用されます。さまざまなアースカラーを与え、特にオークルやシエナカラーを生成するのに役立ちます。
- 廃水処理: 廃水処理プラントでは、Fe(OH)₃ を使用して、産業廃水からリン酸塩や重金属汚染物質を除去します。
- 触媒作用: Fe(OH)₃ は、過酸化水素の分解や酸化反応などのさまざまな化学反応において触媒として機能します。
- 吸着剤: Fe(OH)₃ は、溶液から不純物、汚染物質、染料を除去するための吸着剤として機能します。
- 土壌改良剤: Fe(OH)₃ は土壌改良剤として機能し、土壌の肥沃度と栄養素の利用可能性を改善します。土壌の栄養保持能力を向上させ、植物の成長に必須の鉄分を供給します。
- 実験室用試薬: 実験室では、研究者と分析者は、沈殿反応や pH 調整などのさまざまな分析および研究目的の試薬として Fe(OH)₃ を使用します。
Fe(OH)₃ の多用途用途は、さまざまな産業におけるその重要性と、製薬から環境衛生に至るまでのさまざまなプロセスへの貢献を浮き彫りにしています。
質問:
Q: 水酸化鉄(III) の式の正しい重量はいくらですか?
A: Fe(OH)₃ の正しい式量は約 106.867 g/mol です。
Q: FeBr3 と水酸化バリウムの間の反応の完全なイオン方程式は何ですか?
A: FeBr3 と水酸化バリウムの反応の完全なイオン方程式は、FeBr3 + 3Ba(OH)2 → 3BaBr2 + Fe(OH)3 です。
Q: 75.0 mL を反応させると、どのくらいの質量の水酸化鉄(III) 沈殿物が生成できますか?
A: Fe(OH)₃ 沈殿物の質量を決定するには、反応物の濃度やモル濃度などの追加情報が必要です。
Q: 水酸化鉄(III)はどのように生成すればよいですか?
A: Fe(OH)3 は、鉄塩と塩基の間の沈殿反応、Fe(OH)2 の酸化、鉄塩溶液の加水分解など、さまざまな方法で生成できます。
Q: 水酸化鉄(III)は可溶ですか?
A: いいえ、Fe(OH)₃ は水に溶けません。水に溶解すると沈殿を形成します。
Q: 4.61 グラムの Fe3⁺ には何グラムの Fe(OH)₃ が含まれていますか?
A: Fe(OH)3 のグラムを決定するには、Fe3+ のモル質量と反応の化学量論が必要です。
Q: Fe(OH)₃ は何色ですか?
A: Fe(OH)₃ は一般に茶色です。
Q: 水酸化鉄は固体ですか?
A: はい、水酸化鉄は固体の形で存在します。
Q: 熱分解された水酸化鉄は何を生成しますか?
A: Fe(OH)₃ を熱分解すると、酸化鉄(III) (Fe₂O₃) と水が生成されます。
Q: 水酸化鉄は水に溶けますか?
A: いいえ、水酸化鉄は水に溶けません。水と混合すると沈殿物を形成します。
