水素化リチウムは、リチウムと水素からなる化合物です。反応性が高く、エネルギー貯蔵や核反応などのさまざまな用途に広く使用されています。
| IUPAC名 | 水素化リチウム |
| 分子式 | リヒ |
| CAS番号 | 7580-67-8 |
| 同義語 | 一水素化リチウム、リタン、水素化リチウム、水素化リチウム |
| インチチ | InChI=1S/Li.H |
水素化リチウムの性質
水素化リチウムの配合
一水素化リチウムの化学式は LiH です。水素原子に結合したリチウム原子から構成されます。この単純かつ簡潔な式は、一水素化リチウムの元素組成を表します。
水素化リチウムのモル質量
一水素化リチウムのモル質量は、リチウム (Li) と水素 (H) の原子質量を加算して計算されます。これは、約 7.95 グラム/モル (g/mol) です。モル質量は、特定のサンプル中の物質の量を決定するなど、化学におけるさまざまな計算に不可欠です。
水素化リチウムの沸点
一水素化リチウムは、摂氏約 1,350 度 (華氏 2,462 度) の高沸点を持っています。これは、固体化合物を気体状態に変換するにはかなりの量のエネルギーが必要であることを示しています。
水素化リチウムの融点
一水素化リチウムの融点は非常に高く、摂氏約 688 度 (華氏 1,270 度) です。この温度は、加熱すると固体化合物が液体状態に変化する温度を表します。
水素化リチウムの密度 g/mL
一水素化リチウムの密度は約 0.82 グラム/ミリリットル (g/mL) です。この値は、一水素化リチウムが比較的高密度の化合物であること、つまり単位体積あたりの質量が大きいことを示しています。
水素化リチウムの分子量
一水素化リチウムの分子量は、リチウムと水素の原子量を加算して求められます。これは、約 7.95 グラム/モル (g/mol) です。分子量は、さまざまな化学計算、特に反応の化学量論を決定する際に重要です。
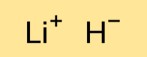
水素化リチウムの構造
一水素化リチウムは、リチウムカチオン(Li+)とヒドリドアニオン(H-)が三次元格子状に配列した結晶構造を持っています。リチウムと水素原子は、強いイオン結合によって結合されています。
水素化リチウムの溶解度
一水素化リチウムは水に溶けにくいです。水と反応して水酸化リチウム (LiOH) と水素ガス (H2) を生成します。この限られた溶解度は、一水素化リチウムの高いイオン性によるもので、水のような極性溶媒には溶解しにくいです。
| 外観 | 白色固体 |
| 比重 | 0.82 |
| 色 | 白 |
| 匂い | 無臭 |
| モル質量 | 7.95g/モル |
| 密度 | 0.82g/ml |
| 融合点 | 688°C (1270°F) |
| 沸点 | 1350°C (2462°F) |
| フラッシュドット | 適用できない |
| 水への溶解度 | 水と反応して水酸化リチウム (LiOH) と水素ガス (H2) を生成します。 |
| 溶解性 | 難溶性 |
| 蒸気圧 | 適用できない |
| 蒸気密度 | 適用できない |
| pKa | 適用できない |
| pH | 適用できない |
水素化リチウムの安全性と危険性
一水素化リチウムには、いくつかの安全上のリスクがあります。水と激しく反応し、可燃性の水素ガスを放出し、腐食性の水酸化リチウムを生成します。湿気や空気と接触すると、引火性の高い水素ガスが発生する可能性があります。偶発的な発火や爆発を避けるために、細心の注意を払って取り扱う必要があります。この化合物は酸との反応性も非常に高く、有毒な水素ガスを発生します。一水素化リチウムは皮膚や目に重篤な刺激を引き起こす可能性があり、その粉塵や煙を吸入すると呼吸困難を引き起こす可能性があります。一水素化リチウムを扱うときは、手袋やゴーグルなどの適切な保護具を着用し、乾燥した換気の良い場所に保管する必要があります。
| ハザードシンボル | 可燃性、腐食性 |
| セキュリティの説明 | 非常に反応性が高く、引火しやすい。取り扱いには細心の注意を払ってください。水、空気、酸との接触を避けてください。 |
| 国連識別番号 | 国連 1414 |
| HSコード | 2850.00.10 |
| 危険等級 | 4.3 (濡れると危険) |
| 梱包グループ | 私(大変危険です) |
| 毒性 | 経口摂取または吸入すると有毒。重度の皮膚や目に炎症を引き起こす可能性があります。 |
水素化リチウムの合成法
一水素化リチウムを合成するには、さまざまな方法を使用できます。
一般的な方法には、金属リチウムと水素ガスを直接組み合わせる方法があります。反応は、制御された環境内で、通常は摂氏 600 度 (華氏 1,112 度) を超える高温で行われます。リチウム金属は水素ガスと反応して一水素化リチウムを形成します。
別の方法は、リチウム金属によるリチウムアミド(LiNH2)の還元です。この反応は、摂氏 350 ~ 400 度 (華氏 662 ~ 752 度) 付近の低温で発生します。リチウムアミドとリチウム金属の反応により、一水素化リチウムが生成されます。
一水素化リチウムの合成は、水素化ホウ素リチウム (LiBH4) と一水素化リチウムそのものを組み合わせることによっても行うことができます。反応は通常摂氏 400 度 (華氏 752 度) 付近の高温で起こります。この方法により、容易に入手可能な水素化ホウ素リチウムから一水素化リチウムを形成できます。
さらに、水素化アルミニウムリチウム (LiAlH4) は、一水素化リチウムの合成の原料として機能します。制御された条件下で、水素化アルミニウムリチウムは金属リチウムと反応し、一水素化リチウムが形成されます。
一水素化リチウムは反応性が高いため、これらの方法では慎重な取り扱いと反応条件の厳密な制御が必要であることに注意してください。合成プロセス中は、不活性雰囲気での作業や適切な保護具の使用などの安全上の注意事項に従う必要があります。
水素化リチウムの用途
一水素化リチウムは、その独特の特性と反応性により、さまざまな用途に使用されます。その用途の一部を次に示します。
- 一水素化リチウムは高度な水素貯蔵システムの開発を可能にし、効率的でコンパクトなエネルギー貯蔵ソリューションを促進します。
- 核反応においては中性子源として機能し、研究施設や原子力発電所で応用されています。
- 有機合成では、さまざまな官能基を還元するための強力な還元剤として一水素化リチウムが使用されます。
- 水または酸との反応により水素ガスを生成するため、現場での水素製造に役立ちます。
- 一水素化リチウムは、他の推進剤と組み合わせると、ロケット エンジンの出力と推力に貢献します。
- 一水素化リチウムは、原子力発電や科学研究に応用される重水素ガスの生成に役割を果たします。
- 湿式冶金プロセスでは、一水素化リチウムを使用して、チタンやジルコニウムなどのさまざまな金属を製造します。
- 化学合成において前駆体または試薬として機能し、有機および無機化合物の形成に寄与します。
- 一部の火工品配合物では、反応中に高熱とガスを発生させるために一水素化リチウムが使用されます。
- 水素化反応では、一水素化リチウムを使用して不飽和化合物に水素を付加し、それによって飽和化合物を形成します。
これらの多様な用途は、複数の産業や科学的取り組みにおける一水素化リチウムの多用途性と重要性を浮き彫りにしています。
質問:
Q: リチウムによって形成される水素化物の式は何ですか?
A: リチウムによって形成される一水素化物の式は LiH です。
Q: 水素化リチウムは二重結合を減らしますか?
A: はい、一水素化リチウムは有機化合物の二重結合を還元することができます。
Q: 水素化リチウムは何を削減しますか?
A: LiH は、有機合成においてさまざまな官能基を還元するために一般的に使用される強力な還元剤です。
Q: 水素化リチウムはイオン性ですか、それとも共有結合性ですか?
A: 一水素化リチウムは、Li+ カチオンと H- アニオンで構成されるイオン性化合物です。
Q: リチウムイオン電池とニッケル水素電池の違いは何ですか?
A: リチウムイオン電池は、ニッケル水素電池よりもエネルギー密度が高く、寿命が長く、軽量です。
Q:水素化リチウムの仕組みは何ですか?
A: 一水素化リチウムのメカニズムは、その具体的な反応や用途によって異なります。還元剤として作用したり、水、酸、その他の化合物と反応したりすることができます。
Q: 水素化リチウムは求核剤ですか?
A: はい、一水素化リチウムは特定の化学反応において求核剤として作用することがあります。
Q: 水素化リチウムからはどのようなアイテムが生まれますか?
A: 一水素化リチウムは、主にエネルギー貯蔵システム、核反応、水素製造、化学合成などの産業用途に使用されます。
Q: 水素化リチウムはアルコールを減らしますか?
A: 一水素化リチウムは、反応条件やその他の要因に応じて、アルコールを対応するアルカンまたはアルデヒドに還元することができます。
