塩素 (Cl2) は、非常に反応性の高い緑がかった黄色のガスです。水処理、消毒剤として、また PVC や溶剤などのさまざまな化学薬品の製造に使用されます。
| IUPAC名 | ジクロル |
| 分子式 | Cl2 |
| CAS番号 | 7782-50-5 |
| 同義語 | 分子状塩素、塩素、クロロ、クロル、クロロ、クロレト デ クロロ |
| インチチ | InChI=1S/Cl2/c1-2 |
Cl2 モル質量
Cl2、つまり塩素のモル質量は、2 つの塩素原子の原子質量の合計、つまり 70.906 g/mol です。化学反応に必要な物質の量を計算するとき、または異なる測定単位間で変換するときに、Cl2 のモル質量を知ることが重要です。
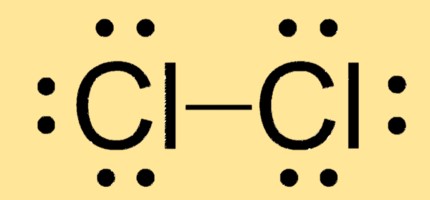
ルイス構造 Cl2
Cl2 は、2 つの塩素原子が単一の共有結合で結合した直線状の分子構造を持っています。そのルイス構造は、それぞれが 3 つの孤立電子対と 1 つの電子対を共有する 2 つの Cl 原子で構成されています。
沸点Cl2
Cl2 の沸点は標準圧力で -34.04°C (-29.27°F) です。これは沸点が比較的低く、室温および常圧でガス状の Cl2 を生成します。 Cl2 は低温、低圧では容易に液体または固体に変化する可能性があるため、取り扱いには注意が必要です。
Cl2 融点
Cl2 の融点は標準圧力で -101.5°C (-150.7°F) です。これは比較的低い融点であり、室温および常圧でガス状の Cl2 を生成します。 Cl2 は低温、低圧では容易に液体または固体に変化する可能性があるため、取り扱いには注意が必要です。
Cl2 密度 g/ml
Cl2 の密度は、標準温度および圧力 (STP) で 0.003214 g/mL です。これは、Cl2 は空気よりもはるかに密度が低く、大気中に上昇することを意味します。 Cl2 は、加圧シリンダー内、または窒素などの空気より重いガスを含むタンク内に保管できます。
塩素の分子量
Cl2 の分子量は 70.906 g/mol です。これは 1 モルの Cl2 の質量で、アボガドロの分子数 (6.022 x 10^23) が含まれます。 Cl2 の分子量は、化学における化学量論的計算にとって重要です。
塩素の構造
Cl2 の構造は直線状で、2 つの塩素原子が共有結合で結合しています。 2 つの塩素原子間の結合長は 1.99 オングストローム、結合エネルギーは 242 kJ/mol です。 Cl2 の電子配置は [Ne]3s23p5 で、各塩素原子が結合対に 1 つの電子を与えます。
塩素式
Cl2 の式は、単純に 2 つの Cl 原子が結合したものです。 Cl-ClまたはCl2で表されます。この式は、化合物または分子の組成を特定したり、化学における化学量論的な計算を行うために重要です。
| 外観 | 黄緑色のガス |
| 比重 | 1.56(液体) |
| 色 | 緑がかった黄色 |
| 匂い | 刺激的で息苦しい臭い |
| モル質量 | 70.906 g/モル |
| 密度 | STPで0.003214 g/mL |
| 融合点 | -101.5°C (-150.7°F) |
| 沸点 | -34.04°C (-29.27°F) |
| フラッシュドット | 不燃性 |
| 水への溶解度 | 0.92 g/100 mL(20℃) |
| 溶解性 | 水、エタノール、エーテル、ベンゼンおよび多くの有機溶媒に可溶 |
| 蒸気圧 | 102.44 kPa(20℃) |
| 蒸気密度 | 2.49 (空気 = 1) |
| pKa | – |
| pH | – |
Cl2 安全性と危険性
塩素は反応性の高いガスであり、適切に取り扱わないと安全性と健康上の重大なリスクを引き起こす可能性があります。深刻な呼吸器への刺激や、目、皮膚、粘膜への損傷を引き起こす可能性があります。高濃度の塩素を吸入すると肺水腫を引き起こす可能性があり、生命を脅かす可能性があります。塩素は非常に腐食性が高く、金属、プラスチック、その他の材料を損傷する可能性があります。塩素を安全に取り扱うために、ゴーグル、手袋、マスクなどの適切な個人用保護具を着用する必要があります。塩素は換気の良い場所でのみ使用し、すべての容器に適切なラベルを貼り、安全な場所に保管する必要があります。
| ハザードシンボル | どくろ |
| セキュリティの説明 | 非常に有毒で腐食性のガス。重度の呼吸器および皮膚の炎症を引き起こします。高濃度で吸入すると致命的になる可能性がある |
| 国連識別番号 | UN1017 |
| HSコード | 2801.1 |
| 危険等級 | 2.3 |
| 梱包グループ | 私 |
| 毒性 | 非常に有毒です。高濃度を吸入すると肺水腫を引き起こし、死に至る可能性があります |
塩素の合成法
塩素ガスを合成するには、食塩電気分解、HCl 酸化、金属塩化物の熱分解など、さまざまな方法があります。
最も一般的な方法は食塩電気分解です。これには、塩化ナトリウム (NaCl) と水 (H2O) の溶液に電流を流すことが含まれます。このプロセスにより、アノードでは塩素ガスが発生し、カソードでは水素ガスが発生します。
塩素を生成する別の方法は、KMnO4 や MnO2 などの酸化剤を使用した HCl の酸化です。この反応では、副生成物として塩素ガスと水が生成されます。
MgCl2 や FeCl3 などの金属塩化物の熱分解は、塩素ガスを発生させるもう 1 つの方法です。このプロセスでは金属塩化物を高温に加熱し、分解して塩素ガスを発生させます。
全体として、塩素に使用される合成方法は、特定の用途と目的のガス純度によって異なります。使用する方法に関係なく、塩素は反応性が高く毒性が高いため、慎重に取り扱うことが重要です。
塩素の使用
塩素ガスはさまざまな産業において幅広く使用されています。塩素の主な用途の 1 つは、広く使用されているプラスチック材料であるポリ塩化ビニル (PVC) の製造です。塩素は、溶媒として使用されるクロロホルムや四塩化炭素などの他の塩素化合物の製造や冷媒の製造にも使用されます。
水処理業界では、飲料水や廃水を処理するための消毒剤として塩素が一般的に使用されています。塩素ガスは細菌やウイルスを殺すのに効果的であり、水から有機化合物やその他の汚染物質を酸化して除去することもできます。
紙パルプ産業では、紙製品を白くするための漂白剤として塩素ガスが使用されます。ナイロンやポリエステルなどの繊維の製造や、染料や顔料の製造にも使用されます。
塩素ガスは他の用途もあり、特に特定の医薬品の製造や冶金産業で金属表面の剥離や洗浄に使用されます。ただし、塩素は危険な性質を持っているため、慎重に取り扱う必要があり、保管、輸送、使用時には適切な安全対策を講じる必要があります。
質問:
Q: Cl2 は極性ですか、それとも無極性ですか?
A: Cl2 は非極性分子です。
Q: 塩素は金属ですか?
A: いいえ、塩素は金属ではありません。それはハロゲンであり、非金属元素のグループに属します。
Q: 塩素と結合して食卓塩を作る軟金属は何ですか?
A: ナトリウム (Na) は、塩素 (Cl) と結合して食塩 (NaCl) を生成する柔らかい金属です。
Q:水を塩素処理するにはどうすればよいですか?
A: 水の塩素化は、一般に、測定された量の塩素ガス、次亜塩素酸ナトリウム、または次亜塩素酸カルシウムを水道に添加することによって行われます。添加する塩素の量は、水質と必要な消毒のレベルによって異なります。塩素は水中のバクテリアやその他の微生物と反応してそれらを効果的に殺し、水を安全な飲料水にします。
Q: 漂白剤を得るために塩素で処理されるものは次のうちどれですか?
A: 酸化カルシウム (CaO) を塩素 (Cl2) で処理すると、さらし粉 (CaOCl2) が得られます。
