塩素酸 (HClO3) は、二酸化塩素を水と混合することによって生成される、強力で不安定な酸です。漂白剤や消毒剤のほか、爆発物の製造にも使用されます。
| IUPAC名 | 塩酸 |
| 分子式 | HClO3 |
| CAS番号 | 7790-93-4 |
| 同義語 | 過塩素酸、塩素酸塩;塩素酸溶液;塩素酸(V);塩素酸水素;三塩素酸水素 |
| インチチ | InChI=1S/ClHO3/c2-1(3)4/h(H,2,3,4) |
塩素酸 (HClO3) の特性は、多くの産業用途に使用されているため、化学者や技術者にとって特に興味深いものです。
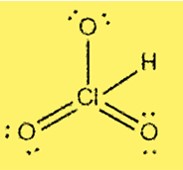
ルイス構造 HClO3
HClO3 のルイス構造は、塩素が 3 つの酸素原子と 1 つの水素原子に結合した中心原子であることを示しています。塩素は 7 つの価電子を持ち、各酸素は 6 つの価電子を持ちます。この構造には、塩素原子と酸素原子の間に 3 つの単結合と 1 つの二重結合が含まれています。
塩素酸(HClO3)の式
塩素酸 (HClO3) の化学式は HClO3 です。塩素原子、水素原子、酸素原子を 3 つ含む無機酸です。塩素酸 (HClO3) の式は、酸を含む溶液の化学量論と濃度を計算するために使用されます。
塩素酸 (HClO3) モル質量
塩素酸 (HClO3) のモル質量は 84.46 g/mol です。これは、モル質量が 98.08 g/mol である硫酸などの他の無機酸と比較して比較的軽い酸です。塩素酸 (HClO3) のモル質量は、酸を含む溶液の濃度と化学量論を計算する際の重要なパラメーターです。
塩素酸(HClO3)の沸点
塩素酸 (HClO3) の沸点は 40.5°C です。これは非常に揮発性の高い酸であり、高温で分解する可能性があるため、取り扱いや保管が困難になります。塩素酸 (HClO3) の沸点が低いことは、酸の使用を伴う装置およびプロセスの設計において重要な考慮事項です。
塩素酸(HClO3)の融点
塩素酸 (HClO3) には明確に定義された融点がありません。融点に達する前に分解して酸素ガスを放出し、塩素酸塩の残留物が残ることがあります。明確な融点がないのは、塩素酸 (HClO3) が不安定であるためです。
塩素酸(HClO3)の密度 g/ml
塩素酸 (HClO3) の密度は 1.97 g/cm3 です。これは、密度 1.18 g/cm3 の塩酸などの他の無機酸と比較して比較的密度の高い酸です。高密度の塩素酸 (HClO3) は、酸の取り扱いと輸送を伴うプロセスの設計において重要な考慮事項です。
塩素酸(HClO3)の分子量
塩素酸 (HClO3) の分子量は 84.46 g/mol です。これは、構成元素の原子量の合計です。塩素原子 1 個、水素原子 1 個、酸素原子 3 個です。塩素酸 (HClO3) の分子量は、酸を含む溶液の濃度と化学量論を計算する際の重要なパラメーターです。
塩素酸(HClO3)の構造
塩素酸の構造は、3 つの酸素原子と 1 つの水素原子に結合した中心の塩素原子で構成されています。この分子は四面体の形状をしており、四面体の中心に塩素原子があります。塩素原子の周りに 3 つの酸素原子が三方晶系の平面配置で配置されており、水素原子は酸素原子の 1 つと結合しています。塩素酸 (HClO3) の構造は、その化学的性質と反応性を理解するために重要です。
| 外観 | 透明または黄色がかった液体 |
| 比重 | 1.97 |
| 色 | 無色~黄色 |
| 匂い | 無臭 |
| モル質量 | 84.46 g/モル |
| 密度 | 1.68 g/cm3 |
| 融合点 | 溶ける前に分解する |
| 沸点 | 40.5℃ |
| フラッシュドット | 適用できない |
| 水への溶解度 | 混和性 |
| 溶解性 | ほとんどの有機溶媒に可溶 |
| 蒸気圧 | 適用できない |
| 蒸気密度 | 適用できない |
| PKa | -0.6 |
| PH | <1 |
塩素酸 (HClO3) の安全性と危険性
塩素酸 (HClO3) にはいくつかの安全上のリスクがあるため、慎重に取り扱う必要があります。これは強力な酸化剤であり、燃料、還元剤、可燃性液体などの多くの有機物質と激しく反応する可能性があります。接触すると皮膚や目に重度の火傷を引き起こす可能性があり、金属表面を腐食させる可能性があります。その蒸気を吸入すると、呼吸器への刺激や咳を引き起こす可能性があります。反応性があるため、他の化学物質から離れた、換気の良い場所で保管および取り扱いする必要があります。塩素酸を取り扱うときは、暴露を避けるために手袋、ゴーグル、呼吸用保護具などの保護具を着用する必要があります。皮膚や目に付着した場合は、直ちに医師の診察を受ける必要があります。
| ハザードシンボル | 酸化剤 |
| セキュリティの説明 | 皮膚や目との接触を避けてください。保護具を着用する |
| AN識別子 | 国連 3084 |
| HSコード | 2811.19 |
| 危険等級 | 5.1 |
| 梱包グループ | Ⅱ |
| 毒性 | 腐食性;皮膚や目に重度の火傷を引き起こす可能性があります |
塩素酸(HClO3)の合成方法
塩素酸は、塩素ガスと水酸化ナトリウムまたは塩素酸ナトリウムの反応など、いくつかの方法で合成できます。一般的な方法は、塩素酸ナトリウムと塩酸の反応です。
塩素酸合成反応には、塩素酸ナトリウム (NaClO3) と塩酸 (HCl) の 2 段階プロセスでの反応が含まれます。最初のステップでは、酸触媒の存在下で塩素酸ナトリウムを亜塩素酸ナトリウム (NaClO2) と二酸化塩素 (ClO2) ガスに変換します。第 2 段階では、二酸化塩素ガスが過剰の塩酸と反応して、塩素酸と塩素ガスが生成されます。
塩素酸を合成する別の方法には、塩化ナトリウム、硝酸、硫酸を含む溶液の電気分解が含まれます。このプロセスでは塩素ガスが生成され、水と反応して塩素酸が生成されます。
塩素酸を生成するには、塩素酸カリウムを硫酸と反応させ、得られた混合物を蒸留します。
塩素酸の合成では、激しい反応の危険性と含まれる酸の腐食性のため、試薬の慎重な取り扱いが必要です。適切な安全手順に従い、適切な保護具を使用して換気の良い場所で材料を取り扱うことが重要です。
塩素酸(HClO3)の使用
塩素酸 (HClO3) は、その強力な酸化特性により、さまざまな産業でいくつかの用途に使用されています。その用途の一部は次のとおりです。
- 他の化学物質の製造: 塩素酸は、過塩素酸、塩素酸塩、過塩素酸塩などの他の化学物質の製造における中間体として機能します。
- 漂白剤: 紙パルプ産業では、塩素酸を漂白剤として使用します。
- 消毒剤: 塩素酸は、食品および飲料業界で機器や表面を消毒する消毒剤として機能します。
- エッチング液: 半導体業界では、半導体ウェーハから不要な材料層を除去するために塩素酸をエッチング液として使用します。
- 実験用試薬: 塩素酸は、分析化学および有機合成の実験用試薬として使用されます。
- 酸化剤: 塩素酸は有機化学反応において酸化剤として使用されます。
- ロケット推進剤: 塩素酸はロケット推進剤の酸化剤として機能します。
- 水処理: 水処理では、藻類や細菌の増殖を抑制するために塩素酸が使用されます。
質問:
Q: 塩素酸は強酸ですか?
A: はい、塩素酸 (HClO3) は強酸です。
Q: 塩素酸を表す式は何ですか?
A: 塩素酸の式は HClO3 です。
Q: なぜ HCl が塩酸で、HClO3 が塩素酸なのか説明してください。
A: 二元酸 (元素が 2 つだけ含まれる化合物) の名前は通常、陰イオンの名前に由来し、最も一般的な陰イオンには接尾辞 -ic が、最も一般的ではない陰イオンには -ous が付きます。 HClの場合、陰イオンは塩化物(Cl-)なので、その酸は塩酸と呼ばれます。 HClO3 の場合、陰イオンは塩素酸塩 (ClO3-) であるため、この酸は塩素酸と呼ばれます。
Q: 塩素酸の式は何ですか?
A: 塩素酸の式は HClO3 です。
Q: 塩素酸はイオン性ですか、それとも分子ですか?
A: 塩素酸は、共有結合した水素、塩素、酸素原子で構成されているため、分子状です。
