塩素酸マグネシウム (Mg(ClO3)2) は、Mg2+ イオンと ClO3- イオンから構成される化合物です。水溶性で反応性の高い白色の結晶性粉末です。花火の製造における酸化剤として、また水処理における消毒剤として使用されます。
| IUPAC名 | 塩素酸マグネシウム |
| 分子式 | Mg(ClO3)2 |
| CAS番号 | 10326-21-3 |
| 同義語 | 二過塩素酸マグネシウム、塩素酸マグネシウム(II)、塩素酸マグネシウム六水和物 |
| インチチ | InChI=1S/2ClHO3・Mg/c2 2-1(3)4;/h2 (H,2,3,4);/q;;+2/p-2 |
塩素酸マグネシウムの性質
塩素酸マグネシウムの配合
塩素酸マグネシウムは、式 Mg(ClO3)2 の化合物です。この化合物は、1 つのマグネシウム イオン (Mg2+) と 2 つの ClO3 イオンで構成されます。化学式によれば、塩素酸マグネシウム 1 分子には 2 つの塩化物イオンと 6 つの酸素原子が含まれています。
塩素酸マグネシウムのモル質量
Mg(ClO3)2 のモル質量は 191.2 g/mol です。この値は、Mg(ClO3)2 の分子内に存在する元素の原子量を加算することによって計算されます。マグネシウムのモル質量は 24.31 g/mol ですが、塩素と酸素のモル質量はそれぞれ 35.45 g/mol と 16.00 g/mol です。各元素のモル質量に分子内のその元素の原子の数を掛けて加算することで、化合物のモル質量が得られます。
塩素酸マグネシウムの沸点
Mg(ClO3)2 は沸点に達する前に分解します。 Mg(ClO3)2 は加熱すると塩化マグネシウム、酸素ガス、塩素ガスに分解します。したがって、Mg(ClO3)2 には沸点がありません。
塩素酸マグネシウム 融点
Mg(ClO3)2の融点は105℃です。この温度では、固体化合物は液体の形に変わります。 Mg(ClO3)2 の融点は、化合物の純度や測定条件によって異なります。
塩素酸マグネシウムの密度 g/mL
Mg(ClO3)2 の密度は 2.21 g/mL です。これは、1 ミリリットルの Mg(ClO3)2 の質量が 2.21 グラムであることを意味します。 Mg(ClO3)2 の密度は、化合物の特定の質量の体積、または化合物の特定の体積の質量を計算するために使用できます。
塩素酸マグネシウムの分子量
Mg(ClO3)2 の分子量は 191.2 g/mol です。この値は、Mg(ClO3)2 の分子内に存在する元素の原子量を加算することによって計算されます。
塩素酸マグネシウムの構造
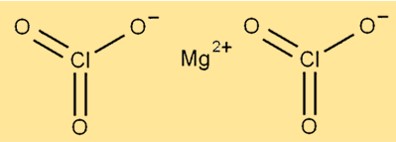
Mg(ClO3)2 の構造は、6 つの酸素原子と 2 つの塩素原子に囲まれたマグネシウムイオンで構成されています。マグネシウムイオンは分子の中心に位置し、酸素原子と塩素原子はその周りに配置されています。この化合物は結晶構造をしており、色は白色です。
塩素酸マグネシウムの溶解度
Mg(ClO3)2 は水、エタノール、アセトンに可溶です。 Mg(ClO3)2 の水への溶解度は温度とともに増加します。室温では、約 31 グラムの Mg(ClO3)2 が 100 ml の水に溶解します。他の溶媒における Mg(ClO3)2 の溶解度は、溶媒の極性に依存します。
| 外観 | 白色の結晶性粉末 |
| 比重 | 2.21g/cm3 |
| 色 | 白 |
| 匂い | 無臭 |
| モル質量 | 191.2g/モル |
| 密度 | 2.21g/ml |
| 融合点 | 105℃ |
| 沸点 | 沸騰する前に分解してしまう |
| フラッシュドット | 適用できない |
| 水への溶解度 | 可溶性 |
| 溶解性 | 水、エタノール、アセトンに可溶 |
| 蒸気圧 | 適用できない |
| 蒸気密度 | 適用できない |
| pKa | 適用できない |
| pH | 適用できない |
塩素酸マグネシウムの安全性と危険性
Mg(ClO3)2 は強力な酸化剤であり、可燃性物質と激しく反応して火災や爆発を引き起こす可能性があります。また、接触または吸入により、皮膚、目、呼吸器系に炎症を引き起こす可能性があります。したがって、Mg(ClO3)2 を取り扱うときは、手袋やゴーグルなどの適切な個人用保護具を使用する必要があります。また、コンパウンドは可燃物や熱源、発火源から遠ざけて保管する必要があります。さらに、化合物からの粉塵や蒸気の吸入を防ぐために、適切な換気を提供する必要があります。 Mg(ClO3)2 は、潜在的な危険を避けるために注意して取り扱う必要があります。
| ハザードシンボル | 酸化剤 |
| セキュリティの説明 | 可燃物との接触を避け、手袋と保護メガネを着用し、適切な換気を確保してください。 |
| 国連識別番号 | UN1475 |
| HSコード | 2829.90.90 |
| 危険等級 | 5.1 |
| 梱包グループ | Ⅱ |
| 毒性 | 皮膚、目、気道に炎症を引き起こす可能性があります。飲み込むと有害になる可能性があります |
塩素酸マグネシウムの合成方法
Mg(ClO3)2 の合成にはさまざまな方法を使用できます。
一般的な方法は、水酸化マグネシウムと塩素酸を反応させることです。反応は次のように進行します。
Mg(OH)2 + 2HClO3 → Mg(ClO3)2 + 2H2O
別の方法は、炭酸マグネシウムと過塩素酸を反応させることです。反応は次のように進行します。
MgCO3 + 2HClO4 → Mg(ClO4)2 + CO2 + H2O
3 番目の方法には、塩素酸ナトリウムまたは塩素酸カリウムなどの塩素酸塩の存在下での塩化マグネシウムの電気分解が含まれます。反応は次のように進行します。
2MgCl2 + 2NaClO3 → Mg(ClO3)2 + 2NaCl
この方法では、電解プロセスでマグネシウム陽極を使用し、酸化剤として塩素酸塩を使用します。
塩素酸マグネシウムの用途
Mg(ClO3)2 はさまざまな分野でさまざまな用途に使用されます。以下にその応用例をいくつか示します。
- 火工品: 照明弾、花火、信号装置などの火工品の酸化剤として一般的に使用されます。
- 化学合成: 医薬品、染料、爆発物などのさまざまな化学物質の合成における酸素源として使用されます。
- 漂白剤: 紙、パルプ、繊維製品の製造において漂白剤として使用されます。
- 水処理:水中に存在する不純物や細菌を除去する水処理剤としても使用されます。
- 実験用試薬: さまざまな分析化学手法で実験用試薬として使用されます。
- 農業: 植物にマグネシウムと酸素を供給する肥料および土壌改良剤として使用されます。
- 石油およびガス産業: 石油およびガス産業の掘削および発破作業で酸化剤として使用されます。
質問:
Q: 塩素酸マグネシウムの式は何ですか?
A: Mg(ClO3)2。
Q: 2.1 モルの Mg(ClO3)2 には原子が何個ありますか?
A: 2.1 モルの Mg(ClO3)2 には 5.04 x 10^24 個の原子が含まれています。
Q: 塩素酸マグネシウムは何に分解されますか?
A: Mg(ClO3)2 は加熱すると塩化マグネシウム、酸素ガス、塩素ガスに変化します。
Q: 塩素酸マグネシウムはどのように分解しますか?
A:Mg(ClO3)2は加熱すると塩化マグネシウムと酸素ガスに分解します。
Q: Mg(ClO3)2 の 1 単位中に存在する酸素原子の総数はいくつですか?
A: Mg(ClO3)2 の 1 単位中には 6 個の酸素原子が存在します。
Q: Mg(ClO3)2 は何に分解されますか?
A: Mg(ClO3)2 は加熱すると分解して MgCl2 と O2 を生成します。
Q: 1 モルの Mg(ClO3)2 中に存在する酸素原子の総モル数は何ですか?
A: 1 モルの Mg(ClO3)2 には 6 モルの酸素原子が存在します。
Q: Mg(ClO3)2 の質量は何グラムですか?
A: Mg(ClO3)2 の式質量 (グラム単位) は 232.21 g/mol です。
Q: Mg(ClO3)2 はイオンですか、それとも分子ですか?
A: Mg(ClO3)2 はイオン性化合物です。
