塩素酸カルシウム (Ca(ClO3)2) は、カルシウム、塩素、酸素から構成される化合物です。花火やマッチの酸化剤としてよく使用されます。食品業界の機器の滅菌にも使用できます。
| IUPAC名 | 塩素酸カルシウム |
| 分子式 | Ca(ClO3)2 |
| CAS番号 | 10137-74-3 |
| 同義語 | 塩素酸、カルシウム塩;水和塩素酸カルシウム;過塩素酸カルシウム;カルシオクロライト; UN1456 |
| インチチ | InChI=1S/Ca.2ClHO3/c;2 2-1(3)4/h;2 (H,2,3,4)/q+2;;/p-2 |
塩素酸カルシウムの性質
塩素酸カルシウムの配合
塩素酸カルシウムの式は Ca(ClO3)2 です。 1 つの Ca2+ イオンと 2 つの ClO3- イオンで構成されています。塩素酸カルシウムはイオン性化合物であり、正イオンと負イオンの間の静電引力によって結合されています。
塩素酸カルシウムのモル質量
Ca(ClO3)2 のモル質量は 206.98 g/mol です。これは、化合物を構成するカルシウム、塩素、酸素の原子量を加算することで計算できます。モル質量は、特定の反応に必要な Ca(ClO3)2 の量を計算するために重要です。
塩素酸カルシウムの沸点
Ca(ClO3)2 は沸点に達する前に分解するため、沸点を持ちません。 Ca(ClO3)2は加熱すると、塩化カルシウム(CaCl2)と酸素ガス(O2)に分解します。この分解は発熱を伴うため、適切に扱わないと危険な場合があります。
塩素酸カルシウム 融点
Ca(ClO3)2の融点は135℃です。これは、固体化合物が固体から液体に変化する温度です。 Ca(ClO3)2 は、室温および常圧で白色の結晶性固体です。
塩素酸カルシウムの密度 g/mL
Ca(ClO3)2 の密度は 2.4 g/mL です。これは、1 ミリリットルの Ca(ClO3)2 の重さが 2.4 グラムであることを意味します。密度は、物質内の分子の密度の尺度です。 Ca(ClO3)2 は水より密度が高く、密度は 1 g/mL です。
塩素酸カルシウムの分子量
Ca(ClO3)2 の分子量は 206.98 g/mol です。これはモル質量と同じであり、化合物内の個々の元素の原子量を加算することで計算できます。
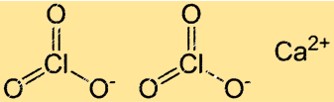
塩素酸カルシウムの構造
Ca(ClO3)2 はイオン性化合物に典型的な結晶格子構造を持っています。この構造では、Ca2+ イオンと ClO3- イオンが規則的な繰り返しパターンで配置されています。各 Ca2+ イオンは 6 つの ClO3- イオンに囲まれ、各塩素酸イオンは 6 つのカルシウムイオンに囲まれています。
塩素酸カルシウムの溶解度
Ca(ClO3)2 は水に可溶で、無色透明の溶液を形成します。 Ca(ClO3)2 の水への溶解度は温度とともに増加します。ただし、エタノールやアセトンなどの有機溶媒にはあまり溶けません。 Ca(ClO3)2 は吸湿性もあり、空気中の水分を吸収します。これにより、時間が経つと化合物が湿ったり、溶けたりする可能性があります。
| 外観 | 白色の結晶固体 |
| 比重 | 2.4 |
| 色 | 無色 |
| 匂い | 無臭 |
| モル質量 | 206.98 g/モル |
| 密度 | 2.4g/ml |
| 融合点 | 135℃ |
| 沸点 | 沸点前に分解する |
| フラッシュドット | 適用できない |
| 水への溶解度 | 可溶性 |
| 溶解性 | 水に溶けるが、有機溶剤には溶けにくい |
| 蒸気圧 | 適用できない |
| 蒸気密度 | 適用できない |
| pKa | 適用できない |
| pH | 適用できない |
塩素酸カルシウムの安全性と危険性
Ca(ClO3)2 は有害物質とみなされており、取り扱いには注意が必要です。これは有機物質と激しく反応し、火災や爆発を引き起こす可能性のある酸化剤です。 Ca(ClO3)2 を吸入または摂取すると、呼吸器および胃腸の炎症を引き起こす可能性があります。長時間暴露すると、皮膚の炎症、火傷、アレルギー反応を引き起こす可能性があります。 Ca(ClO3)2 を取り扱うときは、手袋、ゴーグル、マスクなどの適切な個人用保護具を着用することが重要です。暴露した場合は、直ちに医師の診察を受けてください。 Ca(ClO3)2 は、不適合物質から離れた涼しく乾燥した換気の良い場所に保管してください。
| ハザードシンボル | ああ、Xn |
| セキュリティの説明 | 有機物から遠ざけてください。個人用保護具を着用してください。涼しく乾燥した換気の良い場所に保管してください。 |
| 国連識別番号 | UN1458 |
| HSコード | 2829.11.00 |
| 危険等級 | 5.1 |
| 梱包グループ | Ⅱ |
| 毒性 | 飲み込んだり吸入すると有毒です。皮膚や目に炎症を引き起こす可能性があります。呼吸器への刺激を引き起こす可能性があります。 |
塩素酸カルシウムの合成法
Ca(ClO3)2 を合成するには、さまざまな方法を使用できます。
一般的な方法には、水酸化カルシウムと塩素ガスの反応が含まれます。このプロセスでは、最初に副生成物として塩化カルシウムが形成され、残りの塩素と反応して Ca(ClO3)2 が形成されます。
別の方法には、炭酸カルシウムと硝酸および塩素ガスとの反応が含まれます。 Ca(ClO3)2 を得るには、得られた溶液を蒸発させて結晶化させます。
別のアプローチには、塩化カルシウムと塩素酸ナトリウムを含む溶液の電気分解が含まれます。このプロセスにより、最終生成物として Ca(ClO3)2 と塩化ナトリウムが生成されます。
次亜塩素酸カルシウムと塩素酸ナトリウムの反応により Ca(ClO3)2 が生成され、その後精製および結晶化されます。
塩素酸カルシウムの用途
Ca(ClO3)2 は、さまざまな産業でいくつかの重要な用途があります。 Ca(ClO3)2 の最も一般的な用途のいくつかを以下に示します。
- 漂白剤: 紙パルプ産業で漂白剤として使用されます。
- 花火: 花火の製造に一般的に使用される酸化剤。
- マッチ:着火しやすいため、安全マッチの製造にも使用されます。
- 除草剤: 作物に害を与えることなく特定の雑草を選択的に殺すことができるため、除草剤として使用されます。
- 酸化剤: 過塩素酸塩や塩素酸塩などの他の化学物質の製造において酸化剤として使用されます。
- 医薬品: 抗感染症薬などの医薬品の製造にも使用されます。
- 実験用試薬: 分析化学用の実験用試薬として使用されます。
- 顔料の製造: ウルトラマリンブルーなどの顔料の製造に使用されます。
質問:
Q: 塩素酸カルシウムの式は何ですか?
A: 塩素酸カルシウムの化学式は Ca(ClO3)2 です。
Q: 塩素酸カルシウムは何に使われますか?
A: Ca(ClO3)2 は、紙パルプ産業における漂白剤、他の化学物質の製造における酸化剤、除草剤、製造用顔料、実験用試薬など、産業においてさまざまな用途があります。
Q: 塩素酸カルシウムは固体ですか?
A: はい、Ca(ClO3)2 は室温では固体です。
Q: 塩素酸ナトリウムはどこで最も一般的に見つかりますか? 塩素酸カルシウムは何に使用されますか?
A: 塩素酸ナトリウムは化学産業で最も一般的に見られ、酸化剤や除草剤として使用されます。一方、Ca(ClO3)2 は、さまざまな産業で漂白剤、酸化剤、除草剤として使用されています。
Q: 化合物 Ca(ClO3)2 の原子の総数は何ですか?
A: 化合物 Ca(ClO3)2 には、合計 13 個の原子があります。1 個のカルシウム原子、2 個の塩素原子、および 2 つの ClO3- イオンからの 6 個の酸素原子です。
Q: Ca(ClO3)2 中の塩素の質量パーセントは何ですか?
A: 塩素の原子量は 35.5 g/mol、Ca(ClO3)2 のモル質量は 238.98 g/mol です。したがって、Ca(ClO3)2 中の塩素の質量パーセントは、(2 x 35.5 g/mol) / 238.98 g/mol x 100% = 29.68% となります。
Q: Ca(ClO3)2 には塩素原子が何個ありますか?
A: Ca(ClO3)2 には 2 つの塩素原子があり、2 つの ClO3 基で表されます。
Q: 元の Ca(ClO3)2 と Ca(ClO)2 の混合物中の各化合物の質量はいくらですか?
A: 2 つの化合物の合計質量や質量比などの追加情報がなければ、元の混合物中の各化合物の質量を決定することは不可能です。
