塩化マグネシウム (MgCl2) は、マグネシウムと塩化物イオンから構成される化合物です。マグネシウム欠乏症を治療するためのサプリメントとして、また道路や歩道の凍結防止剤として一般的に使用されています。
| IUPAC名 | 塩化マグネシウム |
| 分子式 | MgCl2 |
| CAS番号 | 7786-30-3 |
| 同義語 | 二塩化マグネシウム、クロロマグネサイト、ビスクロロマグネシウム、塩化マグネシウム(II)、E511、にがり |
| インチチ | InChI=1S/2ClH.Mg/h2*1H;/q;;+2/p-2 |
塩化マグネシウムの配合
塩化マグネシウムの化学式は MgCl2 です。この式は、塩化マグネシウムが 1 つの Mg+2 イオンと 2 つの Cl- イオンから構成されていることを示しています。この式は、化学反応に必要な塩化マグネシウムの量を決定する際に重要です。塩化マグネシウムは、マグネシウム欠乏症を治療するためのサプリメントとして、また道路や歩道の凍結防止剤として一般的に使用されています。
塩化マグネシウムのモル質量
塩化マグネシウムのモル質量は 95.21 g/mol です。 1つのMg+2イオンと2つのCl-イオンから構成される結晶性化合物です。モル質量は、化学反応における物質の量を計算するために使用されるため、塩化マグネシウムの重要な特性です。塩化マグネシウムは、マグネシウム欠乏症を治療するためのサプリメントとして、また道路や歩道の凍結防止剤として一般的に使用されています。
MgCl2の沸点
MgCl2 の沸点は 1,412°C と高く、原子と分子間の結合を切断するには多くのエネルギーが必要です。この特性により、金属や合金の製造などの高温用途に役立ちます。 MgCl2 は、空気中の水分を吸収する乾燥剤として、また化学反応の触媒としても使用されます。
MgCl2の融点
MgCl2 の融点は 714°C であり、室温では固体であることを意味します。この特性により、マグネシウム金属の製造やアルミニウム溶接のフラックスなど、さまざまな用途に役立ちます。 MgCl2 は、豆腐やその他の大豆製品の製造において凝固剤としても使用されます。
密度 MgCl2 g/ml
MgCl2 の密度は 2.32 g/ml です。この性質を利用して、難燃材料の製造や廃水処理など様々な用途に利用されています。 MgCl2 は、道路や高速道路の建設でも粉塵抑制剤として使用されます。
MgCl2の分子量
MgCl2 の分子量は 95.21 g/mol です。この特性は、化学反応に必要な MgCl2 の量を決定するために重要です。 MgCl2 は、マグネシウム欠乏症を治療するためのサプリメントとして、また道路や歩道の凍結防止剤として一般的に使用されています。
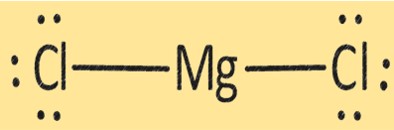
MgCl2の構造
MgCl2 は 1 つの Mg+2 イオンと 2 つの Cl- イオンからなる結晶構造を持っています。 MgCl2 の構造は、その物理的および化学的特性を決定する上で重要です。 MgCl2 は、金属マグネシウムの製造、乾燥剤、豆腐やその他の大豆製品の製造における凝固剤など、さまざまな用途に使用されます。
| 外観 | 白色の結晶固体 |
| 比重 | 2.32g/ml |
| 色 | 白 |
| 匂い | 無臭 |
| モル質量 | 95.21 g/モル |
| 密度 | 2.32g/ml |
| 融合点 | 714℃ |
| 沸点 | 1412℃ |
| フラッシュドット | 適用できない |
| 水への溶解度 | 非常に溶けやすい |
| 溶解性 | 水、エタノール、メタノールに可溶 |
| 蒸気圧 | 適用できない |
| 蒸気密度 | 適用できない |
| pKa | 7.6 (Mg(H2O)6^2+ イオンの場合) |
| pH | 6.0 – 8.0 |
塩化マグネシウムの安全性と危険性
塩化マグネシウム (MgCl2) は、指示に従って使用すれば一般に安全であると考えられています。ただし、正しく扱わないと、いくつかの危険が生じる可能性があります。皮膚や目に炎症を引き起こす可能性があり、粉塵を吸入すると呼吸器疾患を引き起こす可能性があります。大量の MgCl2 を摂取すると、吐き気、嘔吐、下痢を引き起こす可能性があります。また、水路に放出されると水生生物に悪影響を与える可能性があります。 MgCl2 を取り扱うときは、手袋やゴーグルなどの適切な保護具を着用する必要があります。環境へのダメージを避けるために、流出または放出は直ちに封じ込め、清掃する必要があります。
| ハザードシンボル | 何も割り当てられていません |
| セキュリティの説明 | 皮膚や目との接触を避けてください。目に入った場合は水で洗い流してください。取り扱うときは手袋とゴーグルを着用してください。 |
| 国連識別番号 | ONE 2019 |
| HSコード | 28273100 |
| 危険等級 | 8 |
| 梱包グループ | Ⅲ |
| 毒性 | LD50 (経口、ラット) – 4,640 mg/kg; LC50 (吸入、ラット) – 4 時間で >4.4 mg/L |
塩化マグネシウムの合成方法
MgCl2 は、直接合成、塩酸との反応、MgO との反応など、さまざまな方法で合成できます。
直接合成で MgCl2 を生成するには、空気または塩素ガス中でマグネシウム金属を燃焼させて MgO を生成します。次に、MgO と塩酸を反応させて MgCl2 を生成します。
Mg + O2 → MgO
MgO + 2HCl → MgCl2 + H2O
別の方法では、金属 Mg と塩酸を反応させて MgCl2 と水素ガスを生成します。
Mg + 2HCl → MgCl2 + H2
MgO との反応では、MgO と塩酸を混合して MgCl2 と水を生成します。
MgO + 2HCl → MgCl2 + H2O
MgO と塩酸を混合すると、MgO と反応して塩化マグネシウムと水が生成されます。
Mg(OH)2 + 2HCl → MgCl2 + 2H2O
さらに、炭酸ナトリウムを生成するソルベイプロセスの副産物として MgCl2 を得ることができます。このプロセスでは副産物として塩化カルシウムと MgCl2 が生成されますが、これらは炭酸ナトリウム溶液から分離できます。
塩化マグネシウムの用途
塩化マグネシウムは、次のようなさまざまな産業で幅広い用途に使用されます。
- 除氷剤:水の凝固点を下げる能力があるため、冬の間、道路や歩道の除氷剤として使用されます。
- 防塵:未舗装道路や工事現場などの防塵剤として使用されます。
- 食品産業: 豆腐の製造における凝固剤として、また特定の食品のマグネシウム源として使用されます。
- 薬: マグネシウム欠乏症のサプリメントとして、また便秘や胸やけなどの特定の症状の治療として医学的に使用されます。
- 農業: 土壌のマグネシウム含有量と植物の成長を改善するための肥料および土壌改良剤として使用されます。
- 水処理:水処理工程で不純物を除去し、硬水を軟化させるために使用されます。
- 産業用途: 繊維、紙、セメントの製造やさまざまな産業プロセスで使用されます。
- 健康とウェルネス: リラクゼーションを促進し、皮膚の健康を改善するために、入浴などのさまざまな健康とウェルネスの実践に使用されます。
質問:
Q: 塩化マグネシウムの式は何ですか?
A: 塩化マグネシウムの式は MgCl2 です。
Q: 塩化マグネシウムとは何ですか?
A: MgCl2 は、除氷剤、防塵剤、食品添加物など、さまざまな産業や用途で一般的に使用される無機化合物です。
Q: 塩化マグネシウムは溶けますか?
A: はい、MgCl2 は水やその他の極性溶媒に溶けます。
Q: 塩化マグネシウムはイオン性ですか、それとも共有結合性ですか?
A: MgCl2 は、カチオン (Mg2+) とアニオン (Cl-) からなるイオン性化合物です。
Q: MgCl2とは何ですか?
A: MgCl2 は塩化マグネシウムの化学式で、さまざまな産業および消費者用途で使用される無機化合物です。
Q: MgCl2 と NaOH の反応の正味のイオン方程式は何ですか?
A: MgCl2 と NaOH の反応の正味のイオン方程式は、Mg2+ (aq) + 2OH- (aq) → Mg(OH)2 (s) です。
