NiCl2 として知られる塩化ニッケル(II) は、緑がかった黄色の化合物です。これは、電気めっき、触媒、および他のニッケル化合物の合成における前駆体として一般的に使用されます。
| IUPACの名称 | 塩化ニッケル(II) |
| 分子式 | NiCl2 |
| CAS番号 | 7718-54-9 |
| 同義語 | 塩化ニッケル、二塩化ニッケル、ジクロロニッケル、塩化ニッケル |
| インチチ | InChI=1S/2ClH.Ni/h2*1H;/q;;+2/p-2 |
塩化ニッケルの性質
塩化ニッケルの配合
二塩化ニッケルの式はNiCl2です。これは、各二塩化ニッケル分子が 2 つの塩素原子に結合した 1 つのニッケル原子から構成されていることを示しています。この化学式は、化合物に存在する元素の組成と比率に関する重要な情報を提供します。
塩化ニッケルのモル質量
二塩化ニッケルのモル質量は、構成元素の原子質量を加算して計算すると、1 モルあたり約 129.6 グラムです。この値は、特定のサンプル中に存在する二塩化ニッケルの量を決定したり、さまざまな化学量論的計算を行うのに役立ちます。
塩化ニッケルの沸点
二塩化ニッケルの沸点は約摂氏 1.007 度 (華氏 1.845 度) です。この温度で、化合物は液体状態から気体状態に相転移します。沸点は、加熱時の二塩化ニッケルの挙動を理解するのに役立つ重要な物理的特性です。
塩化ニッケルの融点
二塩化ニッケルの融点は約摂氏 1,002 度 (華氏 1,836 度) です。これは、固体の二塩化ニッケルが液体に変化する温度です。融点は、二塩化ニッケルの取り扱いと処理を伴う用途にとって重要です。
塩化ニッケルの密度 g/mL
二塩化ニッケルの密度は 1 ミリリットルあたり約 3.55 グラムです。密度は物質の単位体積あたりの質量の尺度であり、材料の緻密さに関する情報を提供します。二塩化ニッケルの密度は、さまざまな用途やさまざまな物理的状態での挙動を決定するのに役立ちます。
塩化ニッケルの分子量
二塩化ニッケルの分子量は、1 モルあたり約 129.6 グラムです。化合物中のニッケルと塩素の原子量を加算して計算されます。分子量は、化学反応における質量、モル、粒子数の関係を理解するために不可欠です。
塩化ニッケルの構造
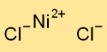
二塩化ニッケルは固体の状態で結晶格子構造をとります。ニッケルカチオン(Ni2+)と塩化物アニオン(Cl-)が交互に配列したものです。この配置は三次元ネットワークを形成し、二塩化ニッケルの安定性と物理的特性に貢献します。
塩化ニッケルの溶解度
二塩化ニッケルは水に中程度の溶解度を持っています。溶解して緑がかった黄色の溶液を形成する場合があります。二塩化ニッケルの溶解度は、温度や他の物質の存在などの要因によって影響されます。その溶解度を理解することは、二塩化ニッケルを含むさまざまな工業プロセスや化学用途において重要です。
| 外観 | 黄緑色の固体 |
| 比重 | 3.55g/ml |
| 色 | 緑がかった黄色 |
| 匂い | 無臭 |
| モル質量 | 129.6g/モル |
| 密度 | 3.55g/ml |
| 融合点 | 1002°C (1836°F) |
| 沸点 | 1007°C (1845°F) |
| フラッシュドット | 適用できない |
| 水への溶解度 | 適度 |
| 溶解性 | 有機溶媒(エタノール、アセトン)および酸に可溶 |
| 蒸気圧 | 利用不可 |
| 蒸気密度 | 利用不可 |
| pKa | 利用不可 |
| pH | 酸(約4) |
塩化ニッケルの安全性と危険性
二塩化ニッケルは、考慮する必要がある特定の安全上のリスクをもたらします。潜在的なリスクを避けるために、この化合物を慎重に取り扱うことが重要です。二塩化ニッケルは皮膚の炎症や感作を引き起こす可能性があるため、取り扱うときは手袋や保護服を着用する必要があります。呼吸器への刺激を引き起こす可能性があるため、二塩化ニッケルの粉塵や蒸気の吸入は避けてください。二塩化ニッケルの摂取は有害な可能性があるため、避けるべきです。さらに、二塩化ニッケルは水生生物に対して有毒であり、水域に放出されると環境破壊を引き起こす可能性があります。二塩化ニッケルに関連するリスクを最小限に抑えるために、適切な保管、取り扱い、廃棄手順に従う必要があります。
| ハザードシンボル | 腐食性、有害性、環境への危険性 |
| セキュリティの説明 | – 手袋と保護服を着用してください – 粉塵や蒸気の吸入を避けてください – 経口摂取を防止してください – 適切に保管、取り扱い、廃棄してください |
| 国連の識別子 | UN3288 |
| HSコード | 2827.39.80 |
| 危険等級 | 8 (腐食性) |
| 梱包グループ | Ⅲ |
| 毒性 | 飲み込むと有害、皮膚や目に炎症を引き起こす |
塩化ニッケルの合成法
二塩化ニッケルを合成するにはいくつかの方法があり、それぞれに独自の利点と用途があります。
一般的な方法には、金属ニッケルまたは酸化ニッケルと塩酸との反応が含まれます。このプロセスでは、金属ニッケルまたは酸化ニッケルを適切な容器に加え、塩酸をゆっくり加えながら撹拌します。ニッケルと酸の反応により、二塩化ニッケルが生成され、水素ガスが発生します。
別の合成方法には、炭酸ニッケルと塩酸の反応が含まれます。塩酸は炭酸ニッケルを溶解し、加熱された溶液は反応して二塩化ニッケルを形成し、二酸化炭素ガスを放出します。
塩酸は加熱または放置すると溶解した水酸化ニッケルと反応し、二塩化ニッケルが合成されます。反応により、二塩化ニッケルと水が生成します。
さらに、二塩化ニッケルは、金属ニッケルを塩素ガスと反応させることによって調製できます。この 2 つの元素間の直接反応により、二塩化ニッケルが得られます。
これらの合成方法は、二塩化ニッケルを取得するためのさまざまなルートを提供し、原料と反応条件の点で柔軟性が得られます。方法の選択は、最終製品の望ましい純度、原材料の入手可能性、特定の用途要件などの要因によって異なります。
塩化ニッケルの用途
二塩化ニッケルは、その独特の特性により、さまざまな業界でさまざまな用途に使用されます。その注目すべき用途のいくつかを以下に示します。
- 電気めっき: 電気めっきプロセスでは通常、二塩化ニッケルを使用して、さまざまな表面に保護および装飾コーティングを施します。二塩化ニッケルは、耐食性を提供しながら、鋼、真鍮、銅などの金属の外観を改善します。
- 触媒: 二塩化ニッケルは、水素化や重合プロセスを含む多くの化学反応において触媒として機能します。反応物質から目的の製品への変換を促進し、医薬品、プラスチック、合成繊維の製造に応用されています。
- 化学合成: 二塩化ニッケルは、酸化ニッケル、硫化ニッケル、シアン化ニッケルなどのさまざまなニッケル化合物の合成における前駆体として機能します。産業では、これらの化合物を触媒、顔料、セラミック、磁性材料に使用しています。
- 電池: 充電式電池、特にニッケル水素 (NiMH) 電池は、電解液として二塩化ニッケルを使用します。これにより、充電および放電サイクル中に電極間のイオンの循環が可能になります。
- ガス精製: 業界では、硫化水素や一酸化炭素などの不純物を除去するためにガス精製プロセスで二塩化ニッケルを使用しています。天然ガス精製や石油化学処理に応用されています。
- 動物飼料サプリメント: 家畜飼料、特に家禽および豚の飼料には、栄養補助食品として二塩化ニッケルが組み込まれています。酵素の活性を促進し、動物の全体的な健康と成長に貢献します。
- 実験室研究: 研究者は、ニッケル触媒反応や化学分析用のニッケルイオン源など、さまざまな実験室で二塩化ニッケルを使用します。
これらの多様な用途は、製造、エネルギーから農業、研究に至るまでの分野における二塩化ニッケルの多用途性と重要性を示しています。
質問:
Q: NiCl2 水溶液にはどのようなイオンが存在しますか?
A: NiCl2 水溶液中に存在するイオンは、Ni2+ (ニッケルカチオン) と Cl- (塩化物アニオン) です。
Q: NiCl2 は水に溶けますか?
A: はい、NiCl2 は水に可溶で、緑がかった黄色の水溶液を形成します。
Q: NiCl2(aq) と自発的に反応する金属はどれですか?
A: マグネシウム (Mg) や亜鉛 (Zn) などの金属は、NiCl2(aq) と自発的に反応してニッケルを置き換え、それぞれの塩化物を形成します。
Q: NiCl2 は極性ですか、それとも無極性ですか?
A: NiCl2 は、ニッケルと塩素の電気陰性度の違いにより極性化合物であり、その結果、電荷の分布が不均等になります。
Q: NiCl2 は水性ですか?
A: はい、NiCl2 は水に溶解すると水溶液を形成して水状態で存在できます。
Q: 式 NiCl2 の化合物の名前は何ですか?
A: 式 NiCl2 の化合物は塩化ニッケル(II)と呼ばれます。
Q: 1.00 L の 0.50 M NiCl2 溶液をどのように準備しますか?
A: NiCl2 の 0.50 M 溶液を調製するには、129.6 グラムの NiCl2 を水に溶解し、体積を 1.00 L にします。
Q: Na2S と NiCl2 の溶液の間に形成される不溶性の塩は何ですか?
A: Na2S の溶液を NiCl2 と混合すると、不溶性の硫化ニッケル (NiS) が形成されます。
Q: NiCl2(aq) は固体ですか?
A: いいえ、NiCl2(aq) は NiCl2 の水溶液を指し、液体の状態であることを示します。
Q: 結晶性塩化ニッケル(II)が緑色になるのはなぜですか?
A: 結晶性塩化ニッケル(II) の緑色は、結晶格子内のニッケル (Ni2+) カチオンの存在によるものです。
Q: 二塩化ニッケルは有毒ですか?
A: はい、二塩化ニッケルは有毒なので、慎重に取り扱う必要があります。皮膚の炎症や呼吸器疾患を引き起こす可能性があり、飲み込むと有害です。
Q: NiCl2 と Na2S の水溶液を組み合わせると反応は起こりますか?
A: はい、NiCl2 と Na2S の水溶液を組み合わせると反応が起こり、不溶性の硫化ニッケル (NiS) と可溶性の塩化ナトリウム (NaCl) が形成されます。
Q: 75.0 mL の 0.555 M 水酸化リチウムを中和するには、何グラムの NiCl2 が必要ですか?
A: 化学量論的反応で 75.0 ml の 0.555 M 水酸化リチウムを中和するには、約 18.4 グラムの NiCl2 が必要です。
Q: 炭酸アンモニウム、二塩化ニッケル、水を混合するとどうなりますか?
A: 炭酸アンモニウム、二塩化ニッケル、水を混合すると反応が起こり、塩化アンモニウム、炭酸ニッケル、水が生成します。
