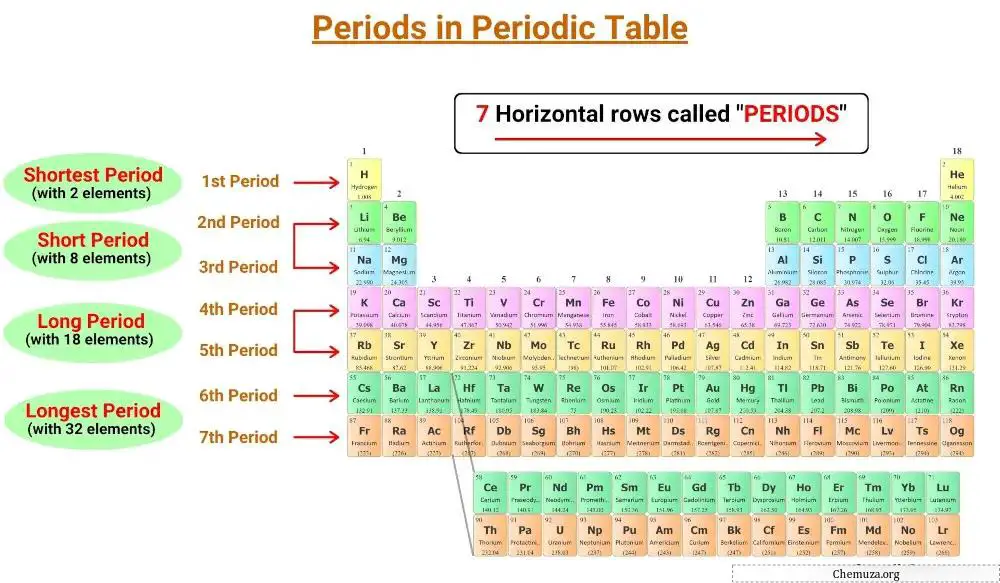
周期表の横線は周期と呼ばれ、周期表には 7 つの周期があります。
同じ周期にある要素は同じ数の電子層を持ちます。
周期表の周期をさらに詳しく調べてみましょう。
周期表の周期とは何ですか?
周期表では、点は左から右へ水平に伸びる線です。
周期表は、同様の特性を持つ元素がグループまたはファミリーと呼ばれる列にグループ化されるように編成されており、同じ時代の元素は同じ数の電子殻を持っています。
周期表には 7 つの周期があり、1 から 7 まで番号が付けられています。 [1]
要素のシェルの数とその周期番号
元素の殻の数によって、周期表におけるその周期が決まります。
たとえば、周期 1 の要素には電子殻が 1 つだけありますが、周期 2 の要素には電子殻が 2 つある、というようになります。
この組織は、化学者が周期表上の位置に基づいて元素の特性を予測するのに役立ちます。
時代の要素の特徴
周期表の周期を移動すると、元素のいくつかの特性が予測可能な方法で変化します。これは、元素の特性に周期的な傾向が観察されるためです。
原子半径:
一定期間にわたって左から右に移動すると、一般に原子半径は減少します。 [2]
これは、原子核内の陽子の数が増加し、最も外側のエネルギー準位で原子核と電子の間の引力が大きくなるからです。これにより、原子半径が小さくなります。
電気陰性度:
電気陰性度は、化学結合において原子が電子を自分自身に引き寄せる能力の尺度です。
一定期間にわたって左から右に移動すると、電気陰性度は一般に増加します。 [3]
これは、原子半径が小さく、原子核の正電荷が強いため、負に帯電した電子がより引き寄せられるためです。
イオン化エネルギー:
イオン化エネルギーは、原子から電子を取り除くのに必要なエネルギー量です。
一定期間にわたって左から右に移動すると、一般にイオン化エネルギーが増加します。 [4]
これは、原子半径が小さくなり、電子が原子核によりしっかりと保持されるため、電子を取り除くことがより困難になるためです。
その他の機能:
融点と沸点:通常、一定の期間にわたって左から右に増加しますが、一部の例外があります。
金属の性質:非金属が普及するにつれて、期間の経過とともに左から右に減少します。
反応性:一定期間にわたって左から右に移動すると、電子がよりしっかりと保持され、化学反応に参加する可能性が低くなるため、元素の反応性は低くなります。
化学における周期の重要性
周期表の周期は、元素の電子配置や他の元素との相互作用に関する情報を提供するため、元素の動作を理解するために不可欠です。化学においてピリオドが重要である理由をいくつか挙げます。
- 特性の予測:科学者は周期表を使用して、表内の位置に基づいて元素の特性を予測できます。たとえば、同じ時代の元素には同じ数の電子殻があり、原子サイズ、反応性、その他の特性を予測するのに役立ちます。
- 傾向を特定する:科学者は、周期表内の元素の配置から、その特性の傾向を特定することができます。たとえば、電気陰性度とイオン化エネルギーは一定期間にわたって左から右に増加する傾向にありますが、原子サイズは減少する傾向があります。この情報は、化学反応において元素がどのように動作するかを予測するために使用できます。
- 元素のグループ化:周期表は、金属、非金属、半金属などの特性に基づいて元素をカテゴリにグループ化します。これは、科学者が元素間の類似点と相違点、およびそれらがどのように相互作用するかを理解するのに役立ちます。
- 新しい元素の発見:周期表は、科学者が新しい元素の存在と特性を予測するのにも役立ちます。科学者は、表のギャップを調べることで、未発見の元素の特性を予測し、実験室で研究することができます。
まとめ
周期表には周期と呼ばれる 7 本の水平線があります。同じ時代の要素には同じ数の電子層があります。周期表には 1 から 7 までの番号が付けられた 7 つの周期があり、元素の殻の数によってその周期が決まります。
周期表の周期が進むにつれて、原子半径は一般に減少し、電気陰性度およびイオン化エネルギーは一般に増加します。融点、沸点、金属の性質、反応性などの他の特性も、時間の経過とともに予測どおりに変化します。
周期表の周期は、元素の特性の予測、傾向の特定、元素のグループ化、および新しい元素の発見にとって重要です。科学者は、表のギャップを調べることで、未発見の元素の特性を予測し、実験室で研究することができます。
