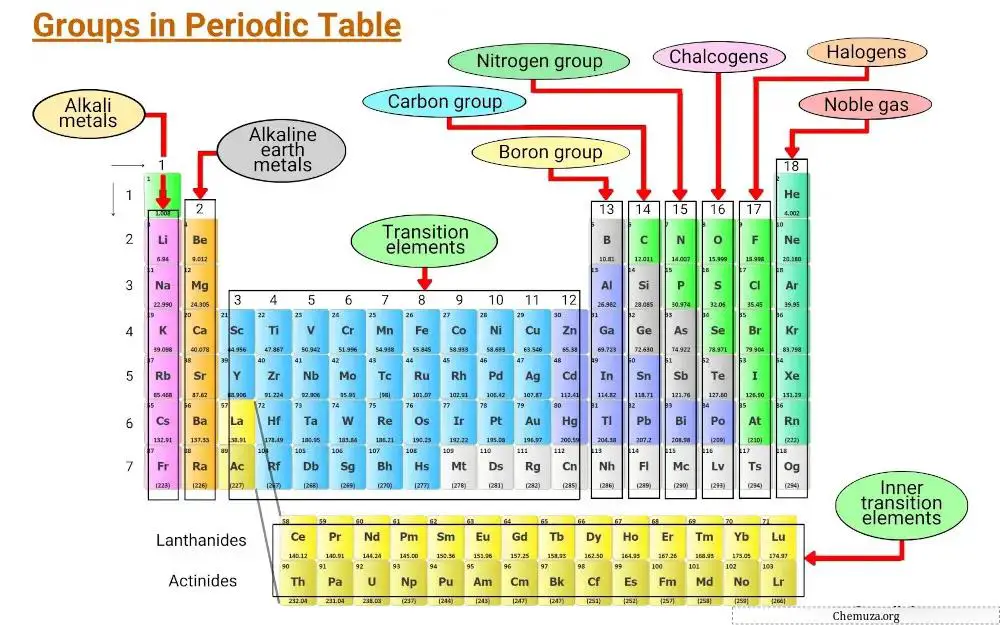
元素は、電子配置や価電子の挙動などの共通の特性に基づいてグループ化されます。
周期表の縦の列は族と呼ばれ、周期表には 18 の族があり、それぞれの族には、元素が他の元素とどのように相互作用して化合物を形成するかを決定する独自の特性セットがあります。
この記事では、周期表上のさまざまなグループについて説明します。
早速本題に入りましょう!
グループ 1: アルカリ金属
このグループには、リチウム、ナトリウム、カリウム、ルビジウム、セシウム、フランシウムが含まれます。
アルカリ金属は、柔らかく、融点が低く、水や空気との反応性が高いことで知られています。
アルカリ金属は、その最外殻に電子を 1 つだけ持っているため、非常に反応性が高く、簡単に電子を放出して陽イオンを形成します。 [1]
このため、優れた電気伝導体となり、電池や工業プロセスなどの多くの用途に役立ちます。
ただし、アルカリ金属は反応性が高いため、取り扱いには注意が必要です。空気中で自然発火し、水と爆発的に反応して水素ガスを放出することがあります。 [2]
グループ 2: アルカリ土類金属
周期表の第 2 族は「アルカリ土類金属」として知られています。このグループには、ベリリウム、マグネシウム、カルシウム、ストロンチウム、バリウム、ラジウムの 6 つの元素が含まれます。
これらの金属は、水と反応してアルカリ性(塩基性)溶液を形成するため、「アルカリ性」と呼ばれます。
アルカリ土類金属は、高い融点と沸点、低い密度、+2 の電荷を持つイオンを容易に形成する能力など、同様の特性を持っています。
また、特に水や酸素に対して非常に反応性が高くなります。ただし、第 1 族アルカリ金属とは異なり、反応性が低く、融点が高くなります。
これらの元素は、骨(カルシウム)、花火(ストロンチウム)、飛行機の部品(マグネシウム)など、多くの日常品に含まれています。
アルカリ土類金属は、アルミニウムや鉄鋼の製造などの工業プロセスでも使用されます。
グループ 3 ~ 11: 遷移金属
周期表の第 3 族から第 11 族は遷移金属族として知られています。これらの金属には、テーブル上の他のアイテムとは一線を画す独特の特徴があります。
遷移金属の特徴の 1 つは、着色された化合物を形成する能力です。
これは、特定の波長の光を吸収および反射できる独自の電子構成によるものです。 [3]
遷移金属は、強度と耐久性だけでなく、融点と沸点が高いことでも知られています。
建材、電気配線、さらには宝石にもよく使用されます。
13族:ホウ素族
周期表の第 13 族はホウ素族として知られ、ホウ素 (B)、アルミニウム (Al)、ガリウム (Ga)、インジウム (In)、タリウム (Tl)、およびニホニウム (Nh) の元素が含まれます。
これらの元素は、化学的に類似する特定の特性を共有しています。
ホウ素はこのグループの唯一の半金属であり、 金属と非金属の両方の特性を持っています。
グループ 14: 炭素グループ
周期表の第 14 族は炭素族として知られており、炭素 (C)、シリコン (Si)、ゲルマニウム (Ge)、錫 (Sn)、鉛 (Pb)、フレロビウム (Fl) が含まれます。
これらの元素はすべて 4 つの価電子を持っているため、同様の特性を持っています。
炭素は、タンパク質や DNA などの生命の構成要素を含むすべての有機分子の基礎を形成するため、非常に重要な元素です。 [4]
グループ 15: プニクトゲン
周期表の第 15 族は窒素族 (またはプニクトゲン) としても知られています。
このグループには、窒素 (N)、リン (P)、ヒ素 (As)、アンチモン (Sb)、ビスマス (Bi)、およびモスコビウム (Mc) の 6 つの元素が含まれています。
15 族元素は最も外側の電子殻に 5 つの価電子を持っており、オクテットを完成させるために 3 つの共有結合を形成する傾向があることを意味します。
また、3 つの電子を獲得して陰イオンを形成する傾向もあります。グループ内の元素は非金属性が減り、金属性が高くなります。
グループ 16: カルコゲン
周期表の第 16 族は酸素族として知られています。これには、酸素 (O)、硫黄 (S)、セレン (Se)、テルル (Te)、ポロニウム (Po)、肝臓 (Lv) の元素が含まれます。
これらの元素は、最も外側のエネルギー準位に 6 つの価電子を持つなど、特定の特徴を共有しています。
酸素はこのグループの中で最も豊富な元素であり、水や多くの有機分子の重要な成分であるため、生命にとって不可欠です。
酸素グループの元素は、金属や非金属を含む他の多くの元素と化合物を形成できます。
グループ 17: ハロゲン
周期表の第 17 族はハロゲン族としても知られています。フッ素、塩素、臭素、ヨウ素、アスタチン、テネシンの6つの元素で構成されています。
すべてのハロゲンは、価電子殻としても知られる最外殻に 7 つの電子を持っています。外殻を完成させて安定化するために余分な電子が 1 つだけ必要なため、非常に反応性が高くなります。
ハロゲンのもう 1 つの重要な特徴は、ハロゲンがすべて非金属であることです。つまり、ハロゲンは電気を通さず、金属のように可鍛性や延性がないことを意味します。
また、室温では 3 つの物質状態すべてで存在し、フッ素と塩素は気体、臭素は液体、ヨウ素とアスタチンは固体です。
グループ 18: 希ガス
希ガスには、ヘリウム (He)、ネオン (Ne)、アルゴン (Ar)、クリプトン (Kr)、キセノン (Xe)、およびラドン (Rn) が含まれます。
これらのガスは非常に安定しており、他の元素と容易に反応しないため、希ガスと呼ばれます。
希ガスは周期表の右端の列に位置し、すべて電子の完全な外殻を持っているため、非常に反応性が低くなります。
また、無臭、無色で、沸点と融点が低いです。
