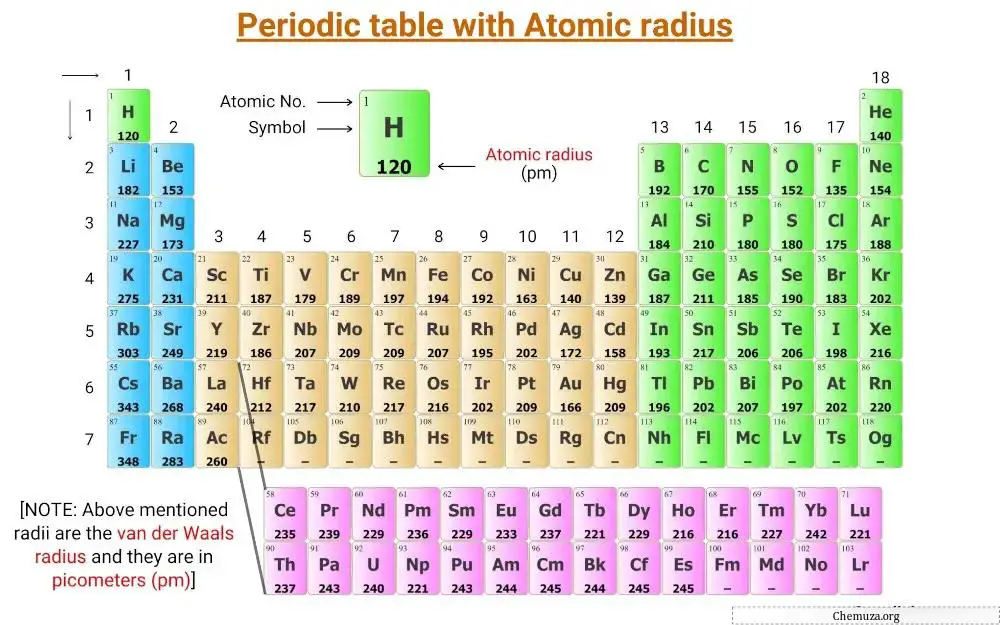
これは、元素の原子半径の値が記載された周期表です。
上記の周期表に記載されている半径はファンデルワールス半径であり、単位はピコメートル(pm) です。
元素の原子半径について、知っておくべき重要な概念的事項はほとんどありません。
それでは早速本題に入りましょう。
原子半径とは何ですか?
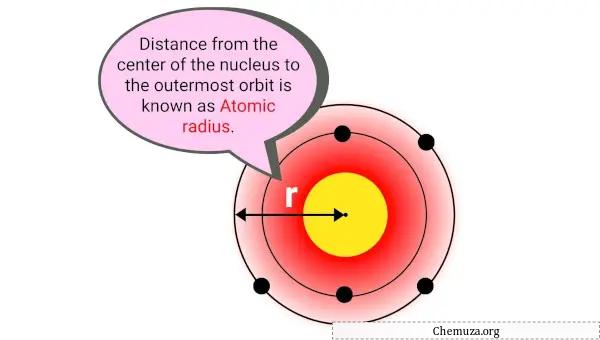
原子半径は、原子核の中心とその電子雲の最も外側の電子との間の距離です。
簡単に言うと原子の大きさです。原子半径は通常、ピコメートル (pm)、つまり 1 兆分の 1 メートルで測定されます。
原子は非常に小さく、視覚化するのが困難ですが、原子半径の概念は、原子がどのように相互作用し、さまざまな化学反応でどのように動作するかを理解するのに役立ちます。
原子のサイズは、他の原子や分子との結合方法など、その化学的特性に影響を与える可能性があります。
原子半径はどのように測定するのでしょうか?
原子半径は通常、X 線結晶構造解析、電子回折、分光法などのさまざまな実験方法を使用して測定されます。
これらの方法には、原子が X 線や電子などの特定の形態のエネルギーと相互作用するときの原子の挙動を研究することが含まれます。
- X 線結晶学では、X 線のビームが研究対象の元素の結晶に向けられます。 X 線は結晶内の原子を回折し、結果として得られる回折パターンを使用して原子間の距離、したがって原子の半径を決定できます。
- 電子回折では、電子ビームが研究対象の元素の薄膜に向けられます。電子が膜を通過すると原子が散乱し、分析して原子半径を決定できる回折パターンが生成されます。
- 分光法には、光と物質の間の相互作用の研究が含まれます。原子が吸収または放出する光の波長を分析することにより、科学者はその原子半径を決定できます。
原子半径に影響を与える要因
原子のサイズは、次のようなさまざまな要因の影響を受けます。
- 核電荷
- 電子構成
- 価電子と原子核との距離など
核電荷
原子核内の陽子の数を原子番号といいます。 [1]
原子番号が増加すると、原子核内の陽子の数が増加し、核電荷が増加します。
この電荷の増加により電子が原子核に向かってより強く引き寄せられ、その結果原子半径が小さくなります。
電子構成
原子核の周りに電子がどのように配置されるかによって、その電子配置が決まります。 [2]
電子が原子核に近づくほど、原子半径は小さくなります。
最も外側のエネルギー準位 (価電子殻) に多くの電子がある原子は、電子が原子核から遠く離れており、原子核への吸引力が弱いため、原子半径が大きくなります。
原子核からの価電子の距離
価電子と原子核の間の距離も原子半径に影響します。
電子殻の数が増加すると、価電子は原子核から遠ざかり、その結果、原子半径が増加します。
原子半径に影響を与える要因は相互に関連していることに注意することが重要です。たとえば、核電荷が増加すると原子半径は小さくなりますが、最も外側のエネルギー準位 (価電子殻) の電子の数が増加すると原子半径は大きくなります。したがって、原子の全体的なサイズは、これらの要素のバランスによって決まります。
詳細については、周期表の原子半径の傾向を参照してください。
まとめ
原子半径は、原子核の中心から電子雲の最も外側の電子までの原子のサイズであり、ピコメートル単位で測定されます。
これは、原子がどのように相互作用し、その化学的特性に影響を与えるかを理解するのに役立ちます。原子半径の測定には、X 線結晶構造解析、電子回折、分光法などの実験的方法が使用されます。
原子半径に影響を与える要因は、核の電荷、電子配置、価電子と原子核の間の距離です。これらの要素は相互に関連しており、原子の全体的なサイズが決まります。
