亜鉛酸ナトリウムは、式 Na2Zn(OH)4 の化合物です。これは、酸化亜鉛ナノ粒子の合成の前駆体として、また有機化学の試薬として使用される白色の固体粉末です。
| IUPAC名 | 亜鉛酸ナトリウム |
| 分子式 | Na2Zn(OH)4 |
| CAS番号 | 12179-14-5 |
| 同義語 | 水酸化亜鉛ナトリウム、亜鉛酸ナトリウム、テトラヒドロキシ亜鉛酸二ナトリウム、亜鉛、四水酸化物 |
| インチチ | InChI=1S/2Na・O2Zn/c;;1-3-5-6-4-2/q2*+1;-2; |
亜鉛酸ナトリウムの配合
亜鉛酸ナトリウムの化学式は Na2Zn(OH)4 で、2 つのナトリウムイオン (Na+) と 1 つの酸化亜鉛イオン (ZnO2-) が含まれていることを示します。この式は化合物の組成を表すために使用され、化合物のモル質量、分子量、およびその他の特性を計算するために使用できます。この式は、化学方程式を書いたり、亜鉛酸ナトリウムが関与する反応生成物を予測したりするためにも使用できます。
亜鉛酸ナトリウムのモル質量:
亜鉛酸ナトリウムのモル質量は、化合物 1 モル中に存在するすべての元素の原子質量を加算することによって計算されます。亜鉛酸ナトリウム (Na2Zn(OH)4) の場合、モル質量は約 179.42 g/mol です。この値は、特定量の溶液を調製するために必要な亜鉛酸ナトリウムの量を決定する場合、または特定のサンプル中の化合物の質量を決定する場合に役立ちます。
亜鉛酸ナトリウムの沸点:
Na2Zn(OH)4 は固体化合物であり、沸点を持ちません。ただし、高温で分解し、生成するガスはその組成に応じて沸点を有する可能性があります。したがって、Na2Zn(OH)4 の沸点は関連する特性ではありません。
亜鉛酸ナトリウムの密度 g/ml:
Na2Zn(OH)4 の密度は約 2.7 g/cm3 です。この値は、Na2Zn(OH)4 の特定の体積の質量を決定する場合、または亜鉛酸ナトリウムの特定の質量の体積を決定する場合に役立ちます。密度は温度と圧力に依存し、実験の特定の条件によって変化する可能性があります。
亜鉛酸ナトリウムの分子量:
Na2Zn(OH)4 の分子量は、分子内のすべての原子の原子量を加算することによって計算されます。亜鉛酸ナトリウムの分子量は約 179.42 g/mol です。分子量は、反応または配合に必要な亜鉛酸ナトリウムの量に関連する計算に使用されるため、重要な特性です。
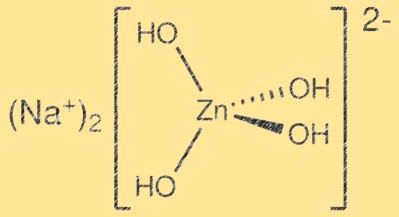
亜鉛酸ナトリウムの構造:
Na2Zn(OH)4 は、ZnO4 四面体と Na2O6 八面体の層からなる複雑な結晶構造を持っています。 ZnO4 四面体は角を共有して三次元格子を形成しますが、Na2O6 八面体は隙間空間を占めます。結果として得られる構造は層状になっており、ウルツ鉱構造の誘導体として説明できます。これらの層はファンデルワールス力によって結合されており、その結果生じる結晶構造は比較的弱いものになります。
| 外観 | 白色固体粉末 |
| 比重 | 2.7g/cm3 |
| 色 | 白 |
| 匂い | 無臭 |
| モル質量 | 179.42 g/モル |
| 密度 | 2.7g/cm3 |
| 融合点 | 該当なし |
| 沸点 | 該当なし |
| フラッシュドット | 該当なし |
| 水への溶解度 | 可溶性 |
| 溶解性 | 水に可溶、有機溶剤に不溶 |
| 蒸気圧 | 該当なし |
| 蒸気密度 | 該当なし |
| pKa | 該当なし |
| pH | アルカリ性 (pH > 7) |
亜鉛酸ナトリウムは固体化合物であるため、引火点や蒸気圧などの一部の特性は亜鉛酸ナトリウムには関係しないことに注意してください。
亜鉛酸ナトリウムの安全性と危険性
Na2Zn(OH)4 には、化合物を取り扱う際に考慮する必要がある特定の安全性と危険性のリスクがあります。 Na2Zn(OH)4 を取り扱うときは、手袋や安全メガネなどの適切な個人用保護具を着用することが重要です。この化合物は皮膚や目に炎症を引き起こす可能性があり、摂取すると胃腸障害を引き起こす可能性があります。 Na2Zn(OH)4 は火災の危険性があるため、熱や発火源から離れた涼しく乾燥した場所に保管する必要があります。 Na2Zn(OH)4 を適切に取り扱い、保管すると、化合物に関連するリスクを最小限に抑えることができます。
| ハザードシンボル | なし |
| セキュリティの説明 | S22:粉塵を吸い込まないでください。 S24/25: 皮膚や目との接触を避けてください。 S37/39: 適切な手袋と目/顔の保護具を着用してください。 |
| 国連識別番号 | 適用できない |
| HSコード | 2834.29 |
| 危険等級 | 危険物として分類されていない |
| 梱包グループ | 適用できない |
| 毒性 | 亜鉛酸ナトリウムの正確な毒性はよくわかっていませんが、皮膚や目に炎症を引き起こす可能性があり、摂取すると有害になる可能性があります。化合物を慎重に取り扱い、適切な個人用保護具を着用することが重要です。 |
亜鉛酸ナトリウムの合成方法
Na2Zn(OH)4 の合成にはいくつかの方法がありますが、最も一般的な方法は、水溶液中で酸化亜鉛と水酸化ナトリウムを混合することです。まず、酸化亜鉛と水酸化ナトリウムを水溶液中で混合する必要があります。次に、透明な溶液が形成されるまで混合物を加熱し、撹拌します。溶液が冷却されると、Na2Zn(OH)4 が溶液から沈殿します。最終生成物を得るには、これを水で洗浄し、乾燥する必要があります。
Na2Zn(OH)4 を合成する別の方法は、水酸化ナトリウム溶液に亜鉛を加え、透明な溶液が形成されるまで混合物を加熱することです。溶液が冷却されると、Na2Zn(OH)4 が溶液から沈殿します。最終生成物を得るには、これを水で洗浄し、乾燥する必要があります。
Na2Zn(OH)4 の合成は換気の良い場所で行い、適切な個人用保護具を着用することが重要です。水酸化ナトリウムは腐食性があり、皮膚や目に炎症を引き起こす可能性があるため、取り扱いには注意が必要です。
亜鉛酸ナトリウムの用途
さまざまな業界が Na2Zn(OH)4 を多目的に使用しています。その主な用途の 1 つは、製造業者がゴム、セラミックス、その他の製品の製造に使用する酸化亜鉛の合成の前駆体としてです。 Na2Zn(OH)4 は、合成繊維やプラスチックの製造において安定剤として機能します。
農業産業では、農家は植物に亜鉛などの必須栄養素を供給するために Na2Zn(OH)4 を肥料として使用します。また、作物を真菌性疾患から保護し、殺菌剤としても機能します。
ジンクイエローなどの顔料のメーカーは、塗料やコーティングに一般的に使用される Na2Zn(OH)4 を製造時に使用します。さらに、業界では金属を腐食から保護するための腐食防止剤として Na2Zn(OH)4 を使用しています。
製薬業界では、Na2Zn(OH)4 は人間の健康に必須の栄養素である亜鉛の供給源として機能します。亜鉛はさまざまな生物学的プロセスに必須の元素であり、健康な免疫システムを維持し、創傷治癒を促進する上で重要な役割を果たします。
全体として、Na2Zn(OH)4 はさまざまな業界で重要な用途があり、多くの潜在的な用途を持つ多用途の化合物です。
質問:
亜鉛酸ナトリウムは塩ですか?
亜鉛酸ナトリウムは、金属 (亜鉛) と塩基 (水酸化ナトリウム) の反応によってイオン性化合物を形成するため、塩とみなされます。静電気力は、正に帯電した亜鉛イオンと、負に帯電したナトリウムおよび水酸化物イオンを一緒に保持します。塩は、酸と塩基、または金属と非金属の反応によって形成されるイオン性化合物です。 Na2Zn(OH)4 は酸と塩基の反応から生じたものではありませんが、それでもイオン性化合物としての塩の一般的な定義を満たしています。
