亜硫酸水素ナトリウム (NaHSO3) は、食品保存料としておよびさまざまな産業用途に使用される化合物です。細菌の増殖を抑え、酸化を防ぐ働きがあります。
| IUPAC名 | 亜硫酸水素ナトリウム |
| 分子式 | NaHSO3 |
| CAS番号 | 7631-90-5 |
| 同義語 | 亜硫酸水素ナトリウム、酸性亜硫酸ナトリウム、亜硫酸水素ナトリウム、亜硫酸水素ナトリウム、亜硫酸ナトリウム一水和物 |
| インチチ | InChI=1S/Na・H2O3S/c;1-4(2)3/h;(H2,1,2,3)/q+1;/p-1 |
亜硫酸水素ナトリウムの性質
亜硫酸水素ナトリウムの処方
亜硫酸水素ナトリウムの化学式は NaHSO3 です。この式は、亜硫酸水素ナトリウムの単一分子に存在する原子の数と種類を示します。この式は、さまざまな化学反応や物理的条件下での亜硫酸水素ナトリウムの挙動を決定する上で非常に重要です。
亜硫酸水素ナトリウムのモル質量
NaHSO3 のモル質量は 104.06 g/mol です。これは、単一の NaHSO3 分子の構成元素の原子量の合計です。モル質量は、特定のサンプル中の物質の量を決定するのに役立つ重要な物理的特性です。
亜硫酸水素ナトリウムの沸点
NaHSO3の沸点は150℃です。これは、液体の NaHSO3 が気体に変わり始める温度です。沸点は、さまざまな温度条件下で物質がどのように挙動するかを決定する重要な物理的特性です。
亜硫酸水素ナトリウム 融点
NaHSO3 の融点は 150°C です。これは、固体の NaHSO3 が液体に変わり始める温度です。融点は、さまざまな温度条件下での物質の挙動を決定するのに役立つ重要な物理的特性です。
亜硫酸水素ナトリウムの密度 g/mL
NaHSO3 の密度は 1.48 g/mL です。これは、所定の体積の NaHSO3 に存在する質量の量を指します。密度は、さまざまな圧力および温度条件下で物質がどのように動作するかを決定するのに役立つ重要な物理的特性です。
亜硫酸水素ナトリウムの分子量
NaHSO3 の分子量は 104.06 g/mol です。これは、単一の NaHSO3 分子の構成元素の原子量の合計です。分子量は、特定のサンプル中の物質の量を決定するのに役立つ重要な物理的特性です。
亜硫酸水素ナトリウムの構造
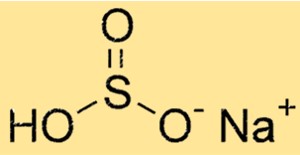
NaHSO3 は、ナトリウムカチオン (Na+) と HSO3- アニオンから構成される分子構造を持っています。アニオンは、1 つの硫黄原子、3 つの酸素原子、および 1 つの水素原子で構成されます。 NaHSO3 の構造は、その化学的および物理的特性を決定します。
亜硫酸水素ナトリウムの溶解度
NaHSO3 は水への溶解度が高く、20℃での溶解度は 62 g/100 mL です。グリセロールにも溶け、アルコールにもわずかに溶けます。水に溶けやすいため、さまざまな化学反応で有用な試薬となります。
| 外観 | 白色の結晶性粉末 |
| 比重 | 1.48 |
| 色 | 白色からわずかに黄色 |
| 匂い | 硫黄臭 |
| モル質量 | 104.06 g/モル |
| 密度 | 1.48g/ml |
| 融合点 | 150℃ |
| 沸点 | 150℃ |
| フラッシュドット | 適用できない |
| 水への溶解度 | 非常に溶けやすい |
| 溶解性 | エタノールに可溶 |
| 蒸気圧 | 適用できない |
| 蒸気密度 | 適用できない |
| pKa | 6.97 |
| pH | 4.5-5.5 (5%溶液) |
亜硫酸水素ナトリウムの安全性と危険性
NaHSO3 は、摂取、吸入、または皮膚や目に接触すると有害となる可能性があります。皮膚の炎症、目の損傷、呼吸器や消化器系の問題を引き起こす可能性があります。長期間暴露すると、より深刻な健康上の問題を引き起こす可能性があります。手袋、ゴーグル、呼吸用保護具などの個人用保護具を使用して、NaHSO3 を慎重に取り扱い、保管することが重要です。可燃物や不適合物質から遠ざけて保管する必要があります。誤って接触または摂取した場合は、直ちに医師の診察を受ける必要があります。潜在的な危険を避けるために、適切な保管および取り扱い手順に従う必要があります。
| ハザードシンボル | どくろ、腐食性 |
| セキュリティの説明 | 皮膚、目、衣類との接触を避けてください。摂取したり吸入したりしないでください。適切な保護具を使用してください。 |
| 国連識別番号 | UN2693 |
| HSコード | 28321000 |
| 危険等級 | 8 |
| 梱包グループ | Ⅲ |
| 毒性 | 摂取または吸入すると非常に有毒です。皮膚や目の炎症、呼吸器や消化器系の問題を引き起こす可能性があります。長期間暴露すると、深刻な健康上の問題を引き起こす可能性があります。 |
亜硫酸水素ナトリウムの合成方法
NaHSO3 を合成するにはさまざまな方法がありますが、最も一般的な方法は、炭酸ナトリウムと二酸化硫黄を反応させることです。
NaHSO3 溶液を生成するには、炭酸ナトリウムの溶液と二酸化硫黄ガスを混合します。反応は熱を放出するため、適切な換気を備えた反応容器が必要です。
別の方法では、水酸化ナトリウムと二酸化硫黄ガスを反応させて亜硫酸ナトリウム溶液を生成し、これを酸性化して NaHSO3 溶液を生成します。大量の NaHSO3 の場合、この方法が有用であることがわかります。
NaHSO3 を合成するには、硫酸を亜硫酸ナトリウムと反応させて、NaHSO3 溶液を生成します。この方法は、より濃縮された NaHSO3 溶液が必要な場合に有益です。
亜硫酸水素ナトリウムの用途
NaHSO3 はさまざまな産業で幅広い用途に使用されます。一般的な用途のいくつかを次に示します。
- 食品産業 – バクテリアの増殖を防ぎ、缶詰の果物や野菜、ジュース、ワインなどの食品の保存期間を延ばすための食品保存料として使用されます。
- 水処理 – 飲料水および廃水処理システムから過剰な塩素を除去するための還元剤として使用されます。
- 繊維産業 – 繊維から残留染料を除去するための漂白剤として使用されます。
- 写真産業 – 写真処理の現像剤として使用されます。
- 石油掘削 – 腐食防止剤として、また石油およびガスの掘削作業中に酸素を除去して腐食を防ぐための回収システムとして使用されます。
- 医薬品 – 特定の医薬品の製造において抗酸化剤および還元剤として使用されます。
- パーソナルケア – 縮毛矯正剤として、またシャンプーやコンディショナーなどのパーソナルケア製品の製造に使用されます。
- その他の用途 – 紙やパルプの製造、実験用試薬、金属イオンキレート剤として使用されます。
質問:
Q:NaHSO3とは何ですか?
A: NaHSO3 は、さまざまな業界でさまざまな目的に使用される塩である亜硫酸水素ナトリウムの化学式です。
Q: 0.015 M NaHSO3 のおよその pH はどれくらいですか?
A: 0.015 M NaHSO3 のおおよその pH は約 7 です。この溶液は酸でも塩基でもないため中性です。
Q: NaHSO3 は酸性ですか、それとも塩基性ですか?
A: NaHSO3 は、水中の水素イオンを供与して HSO3- および H+ イオンを形成する可能性があるため、弱酸性です。
Q: この実験で使用した反応物質の 1 つである NaHSO3 の硫黄 (S) の酸化数は何ですか?
A: NaHSO3 中の硫黄 (S) の酸化数は +4 です。
Q: NaHSO3 は何をしますか?
A: NaHSO3 は還元剤および二酸化硫黄の供給源として使用されます。また、食品や医薬品の抗酸化剤および防腐剤としても機能します。
Q: 1.00 kg の I2 を準備したい場合、どのくらいの質量の NaIO3 と NaHSO3 が必要ですか?
A: NaIO3 と NaHSO3 が反応して I2 を形成する平衡化学式は、5NaIO3 + NaHSO3 + 3H2O → 3I2 + 5NaSO4 + 3H2SO4 です。化学量論を使用すると、1.00 kg の I2 を調製するには、3.33 kg の NaIO3 と 1.00 kg の NaHSO3 が必要になります。 。
Q: 反応の最後に亜硫酸水素ナトリウムを添加したのはなぜですか?
A: NaHSO3 は、化学反応の最後に過剰な臭素を除去するために添加されます。臭素は有害な場合やプロセスの後のステップを妨げる可能性があります。
Q: 亜硫酸水素ナトリウムとは何ですか?
A: NaHSO3 は、食品、医薬品、水処理などのさまざまな業界で、還元性、抗酸化性、防腐性を目的として使用される塩です。
Q: 亜硫酸水素ナトリウムは臭素をどのように除去しますか?
A: NaHSO3 は臭素と反応して臭化ナトリウムと二酸化硫黄ガスを形成し、溶液から過剰な臭素を効果的に除去します。
Q: メナジオン亜硫酸水素ナトリウム複合体とは何ですか?
A: メナジオン重亜硫酸ナトリウム複合体は、一部の栄養補助食品やペットフード製品でビタミン K 源として使用される合成化合物です。
Q: 亜硫酸水素ナトリウムは何に使用されますか?
A: NaHSO3 は、食品、製薬、水処理、石油掘削などのさまざまな業界で還元剤、酸化防止剤、防腐剤として使用されています。縮毛矯正剤や写真処理にも使用できます。
