亜硫酸マグネシウム (MgSO3) は、マグネシウムと亜硫酸イオンから構成される化合物です。食品業界では食品保存料および酸化防止剤として一般的に使用されています。
| IUPAC名 | 亜硫酸マグネシウム |
| 分子式 | MgSO3 |
| CAS番号 | 7757-88-2 |
| 同義語 | スルホン酸マグネシウム、三酸化硫黄マグネシウム、E-536 |
| インチチ | InChI=1S/Mg.H2O3S/c;1-4(2)3/h;(H2,1,2,3)/q+2;/p-2 |
亜硫酸マグネシウムの性質
亜硫酸マグネシウムの配合
亜硫酸マグネシウムの化学式は MgSO3 で、マグネシウム原子 1 個、硫黄原子 1 個、酸素原子 3 個で構成されていることを示します。亜硫酸イオンは、式 SO3 2- を持つ多原子イオンで、3 つの酸素原子に結合した中心の硫黄原子から構成されます。 Mg イオンは +2 の電荷を持ち、SO3 2- イオンは -2 の電荷を持っているため、化合物は電気的に中性になります。
亜硫酸マグネシウムのモル質量
MgSO3 のモル質量は 104.37 g/mol で、これは 1 つのマグネシウム原子、1 つの硫黄原子、および 3 つの酸素原子の原子質量の合計に相当します。この値は、化学方程式の化学量論を決定するだけでなく、特定の反応に必要な MgSO3 の量を計算するために重要です。
亜硫酸マグネシウムの沸点
MgSO3 は沸点に達する前に分解するため、特定の沸点はありません。代わりに、700℃を超える温度で酸化マグネシウムと二酸化硫黄に分解し始めます。この分解プロセスは空気や湿気にさらされると加速される可能性があり、MgSO3 は比較的不安定な化合物になります。
亜硫酸マグネシウム 融点
MgSO3の融点は約150℃です。この温度で、化合物は酸化マグネシウムと二酸化硫黄に分解し始めます。分解プロセスは発熱的であり、熱を放出します。 MgSO3 の融点は、溶解度や結晶構造など、固体としての特性を理解するために重要です。
亜硫酸マグネシウムの密度 g/mL
MgSO3 の密度はその物理的形状によって異なりますが、一般的には 2.5 ~ 3.0 g/mL の範囲です。この値は、所定の体積の MgSO3 の質量を決定するため、および溶液中での MgSO3 の挙動を理解するために重要です。 MgSO3 の密度は、水と比較した相対密度の尺度である密度を計算するために使用することもできます。
亜硫酸マグネシウムの分子量
MgSO3 の分子量は 104.37 g/mol です。この値は、化合物の物理的および化学的特性を理解するため、また特定の反応に必要な MgSO3 の量を計算するために重要です。 MgSO3 の分子量は、マグネシウム原子 1 個、硫黄原子 1 個、酸素原子 3 個の原子量を加算することで計算できます。
亜硫酸マグネシウムの構造
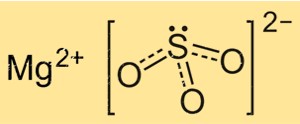
MgSO3 の構造は、Mg+2 イオンと SO3 2- イオンの結晶格子に基づいています。 Mg+2 イオンは、八面体状に配置された 6 つの酸素原子に囲まれていますが、SO3 2- イオンは 2 つの酸素原子を介してマグネシウム イオンに結合しています。 MgSO3 の結晶構造は、溶解度や反応性などの物理的および化学的特性を理解するために重要です。
亜硫酸マグネシウムの溶解度
MgSO3 は水に溶けにくく、室温での溶解度は約 7.5 g/L です。この溶解度の低さは、化合物の結晶構造により、水分子が固体に浸透して溶解することが困難になるためです。 MgSO3 は、酸が亜硫酸イオンと反応して重亜硫酸塩と亜硫酸を形成する可能性があるため、酸性溶液への溶解性が高くなります。 MgSO3 の溶解度は、溶液中での MgSO3 の挙動を理解するだけでなく、食品保存剤および抗酸化剤としての MgSO3 の有効性を判断するためにも重要です。
| 外観 | 白い粉末または結晶 |
| 比重 | 2.5~3.0 |
| 色 | 白 |
| 匂い | 無臭 |
| モル質量 | 104.37 g/モル |
| 密度 | 2.5~3.0g/ml |
| 融合点 | 150℃程度 |
| 沸点 | 700℃以上で分解する |
| フラッシュドット | 適用できない |
| 水への溶解度 | 難溶性、室温で約 7.5 g/L |
| 溶解性 | 酸性溶液への溶解性が高い |
| 蒸気圧 | 適用できない |
| 蒸気密度 | 適用できない |
| pKa | 適用できない |
| pH | 適用できない |
亜硫酸マグネシウムの安全性と危険性
MgSO3 は、それほど危険な物質とは考えられていません。ただし、接触または吸入すると、目、皮膚、気道に炎症を引き起こす可能性があります。 MgSO3 を摂取すると、胃腸の炎症を引き起こし、場合によっては嘔吐を引き起こす可能性があります。高濃度に長期間暴露すると、肺の損傷や呼吸器への刺激を引き起こす可能性があります。したがって、適切な個人用保護具を着用し、粉塵や煙の吸入を避けるなど、MgSO3 を注意深く取り扱うことが重要です。 MgSO3 は、強力な酸化剤、酸、塩基などの不適合物質から離れた、涼しく乾燥した換気の良い場所に保管する必要があります。
| ハザードシンボル | なし |
| セキュリティの説明 | 粉塵や煙の吸入を避けてください。適切な個人用保護具を着用してください。 |
| 国連識別番号 | 規制されていません |
| HSコード | 2833.29 |
| 危険等級 | 危険物として分類されていない |
| 梱包グループ | 適用できない |
| 毒性 | 毒性は低く、接触または吸入すると目、皮膚、気道に炎症を引き起こす可能性があります。摂取すると胃腸の炎症を引き起こし、場合によっては嘔吐を引き起こす可能性があります。高濃度に長期間暴露すると、肺の損傷や呼吸器への刺激を引き起こす可能性があります。 |
亜硫酸マグネシウムの合成法
MgSO3 は、亜硫酸または二酸化硫黄ガスと酸化マグネシウムまたは水酸化マグネシウムとの反応など、さまざまな方法で合成できます。
1 つの方法では、酸化マグネシウムと水の反応により水酸化マグネシウムが形成され、それが亜硫酸と反応して MgSO3 が生成されます。
別の方法では、水の存在下で水酸化マグネシウムを二酸化硫黄ガスと反応させて MgSO3 を形成します。
別の方法では、硫酸マグネシウムを亜硫酸ナトリウムまたは亜硫酸カリウムと反応させることにより、MgSO3 を合成できます。この反応により MgSO3 の沈殿が生成され、研究者はこれを濾過と乾燥によって単離できます。
水の存在下で酢酸マグネシウムと二酸化硫黄ガスを反応させると、MgSO3 が生成します。次に、得られた MgSO3 沈殿物を洗浄し、乾燥させます。
これらの方法は、紙やパルプの製造、食品や飲料の加工、水処理などのさまざまな用途向けに MgSO3 を生成するために使用できます。
亜硫酸マグネシウムの用途
MgSO3 はさまざまな産業でさまざまな用途に使用されます。一般的な用途のいくつかを次に示します。
- 水処理:腐食やスケールの形成を防ぐため、ボイラー水処理における脱酸素剤として使用されます。
- 食品および飲料の加工: 食品および飲料の加工において保存期限を延ばし、腐敗を防ぐために防腐剤および酸化防止剤として使用されます。
- パルプおよび紙の生産: 紙パルプ産業で紙製品の明るさと色を改善するために漂白剤として使用されます。
- 繊維製造: 繊維製造において過剰な酸素を除去し、最終製品の品質を向上させるために還元剤として使用されます。
- 農業: 植物の成長を促進し、作物の収量を増やすための葉面散布として使用されます。
- 薬: 抗酸化作用と抗炎症作用があるため、伝統医学で使用されています。
- 化粧品:乳化剤、安定剤、pH調整剤として化粧品に使用されます。
- その他の用途: 接着剤、塗料、コーティングの製造、廃水処理プロセスにも使用されます。
質問:
Q: 亜硫酸マグネシウムの式は何ですか?
A: 亜硫酸マグネシウムの化学式は MgSO3 です。
Q: 2.4 モルのサンプルにはどのくらいの亜硫酸マグネシウムが含まれていますか?
A: 2.4 モルの MgSO3 のサンプルには、2.4 モルの MgSO3 が存在します。
Q: 亜硫酸マグネシウム 1 モル中の各元素の質量パーセントは何ですか?
A: 亜硫酸マグネシウム 1 モル中のマグネシウムの質量百分率は 32.44%、硫黄は 29.44%、酸素は 38.12% です。
Q: 亜硫酸マグネシウムは筋肉のけいれんを止めますか?
A: MgSO3 が筋肉のけいれんを止めることができることを示唆する科学的証拠はありません。ただし、この目的には硫酸マグネシウム (エプソムソルト) が使用されています。
Q: 反応に亜硫酸マグネシウムを添加するとどのような影響がありますか?
A: MgSO3 を添加すると、特定の反応において酸素を除去して還元剤として作用することがあります。特定の用途では防腐剤や酸化防止剤としても機能します。
Q: 亜硫酸マグネシウムはイオン性ですか、それとも分子ですか?
A: MgSO3 はイオン性化合物です。
