三臭化ホウ素 (BBr3) は、さまざまな反応で触媒として使用される化合物です。 1 つのホウ素原子と 3 つの臭素原子から構成されます。
| IUPAC名 | 三臭化ホウ素 |
| 分子式 | BBr3 |
| CAS番号 | 10294-33-4 |
| 同義語 | トリブロモボラン;臭化ホウ素;臭化ホウ素(III);ブロモボア。三臭化ホウ素、[B(Br)3];トリブロモボラン |
| インチチ | InChI=1S/3BrH.B/h3*1H;/q;;;+3/p-3 |
三臭化ホウ素の性質
三臭化ホウ素の配合
臭化ホウ素の式はBBr3です。 1 つのホウ素原子と 3 つの臭素原子から構成されます。この化合物はホウ素と臭素の組み合わせによって形成されます。
三臭化ホウ素モル質量
臭化ホウ素 (BBr3) のモル質量は、ホウ素原子と 3 つの臭素原子の原子質量を加算することで計算できます。ホウ素の原子量は 1 モルあたり約 10.81 グラム、臭素の原子量は 1 モルあたり約 79.90 グラムです。したがって、BBr3 のモル質量は 1 モルあたり約 250.60 グラムです。
三臭化ホウ素の沸点
臭化ホウ素は沸点が比較的低いです。約摂氏91度(華氏196度)で沸騰し始めます。この温度では、化合物は液体から気体への相変化を起こし、BBr3 蒸気を放出します。
三臭化ホウ素 融点
臭化ホウ素の融点は比較的高いです。摂氏マイナス46度(華氏マイナス51度)あたりから溶け始めます。この温度では、固体化合物は液体状態に変わります。
三臭化ホウ素の密度 g/mL
臭化ホウ素の密度は約 2.63 グラム/ミリリットル (g/mL) です。この密度は、化合物 1 ミリリットル中に存在する BBr3 の質量を示します。これは、物質の緻密さまたは濃度の尺度です。
三臭化ホウ素の分子量
臭化ホウ素 (BBr3) の分子量は、ホウ素原子と 3 つの臭素原子の原子量を加算することによって計算されます。 BBr3 の分子量は 1 モルあたり約 250.60 グラムです。
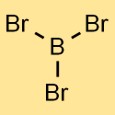
三臭化ホウ素の構造
臭化ホウ素の構造は、3 つの臭素原子に結合した 1 つのホウ素原子から構成されます。この配置は三方晶系の平面幾何学を形成し、ホウ素原子が中心にあり、3 つの臭素原子がその周りに均等に分布しています。
三臭化ホウ素の溶解度
臭化ホウ素は非常に反応性の高い化合物であり、一般に水に溶けにくいです。水と反応して臭化水素酸とホウ酸を生成する傾向があります。ただし、BBr3 はクロロホルム、四塩化炭素、二硫化炭素などの有機溶媒に可溶です。
| 外観 | 無色の液体 |
| 比重 | 2.63g/ml |
| 色 | 無色 |
| 匂い | エーカー |
| モル質量 | 250.60 g/モル |
| 密度 | 2.63g/ml |
| 融合点 | -46℃ |
| 沸点 | 91℃ |
| フラッシュドット | 適用できない |
| 水への溶解度 | 反応する |
| 溶解性 | クロロホルム、CCl4、二硫化炭素などの有機溶媒に可溶 |
| 蒸気圧 | 78mmHg |
| 蒸気密度 | 6.52 (空気=1) |
| pKa | 適用できない |
| pH | 適用できない |
三臭化ホウ素の安全性と危険性
臭化ホウ素は安全上のリスクを引き起こすため、この化合物を取り扱う際には注意が必要です。皮膚、目、呼吸器系に対して腐食性があります。直接接触すると火傷や重度の炎症を引き起こす可能性があります。その蒸気を吸入すると、呼吸器系の不快感を引き起こす可能性があります。水と激しく反応し、有毒なフュームを発生します。したがって、換気の良い場所で取り扱う必要があり、手袋やゴーグルなどの適切な個人用保護具を着用する必要があります。湿気や不適合物質から遠ざけて保管する必要があります。暴露した場合は、直ちに医師の診察が必要です。臭化ホウ素に関連するリスクを最小限に抑えるために、適切な安全プロトコルとガイドラインに従う必要があります。
| ハザードシンボル | 腐食性があり、濡れると危険です |
| セキュリティの説明 | 皮膚、目、衣類との接触を避けてください。換気の良い場所で使用してください。手袋と保護メガネを着用してください。 |
| 国連識別番号 | UN3264 |
| HSコード | 2811.19.9000 |
| 危険等級 | 8 |
| 梱包グループ | Ⅱ |
| 毒性 | 吸入および経口摂取すると有毒。重度の皮膚火傷や目の損傷を引き起こします。 |
三臭化ホウ素の合成方法
臭化ホウ素はさまざまな方法で合成できます。一般的な方法には、酸化ホウ素 (B2O3)と臭素 (Br2) の反応が含まれます。この反応は、炭素やアルミニウムなどの触媒の存在下、高温で起こります。結果として生じる反応により臭化ホウ素が生成され、酸素ガスが発生します。
別の方法には、三塩化ホウ素 (BCl3)と臭素の間の反応が含まれます。この反応は室温で起こり、副生成物として臭化ホウ素と塩素ガスが生成されます。
臭化ホウ素を調製するには、制御された環境内でホウ素を過剰の臭素と反応させることができ、高温と反応条件の慎重な制御が必要です。
別の方法は、ジボラン (B2H6) またはボラン (BH3) などの水素化ホウ素と臭化水素 (HBr) を反応させることによって臭化ホウ素を合成することです。この反応により、生成物として臭化ホウ素と水素ガスが生成されます。
臭化ホウ素は反応性が高いため、これらの合成方法には注意が必要であることに注意してください。合成プロセス中は、適切な保護具の着用や換気の良い場所での作業など、適切な安全プロトコルに従う必要があります。
三臭化ホウ素の用途
臭化ホウ素 (BBr3) は、さまざまな業界でいくつかの重要な用途があります。いくつかの主要なアプリケーションを次に示します。
- 触媒: BBr3 は有機合成反応を積極的に触媒し、アシル化、アルキル化、ハロゲン化反応などのプロセスを可能にします。
- 化学中間体: BBr3 は、他のホウ素化合物の生成における前駆体として機能し、ホウ素含有試薬、ボロン酸、およびホウ素ベースのポリマーを合成します。
- 重合: BBr3 は重合反応、特にポリエチレンやポリプロピレンなどのポリマーの製造に積極的に関与し、ルイス酸触媒として機能します。
- ドーピング剤: 半導体業界では、電子デバイスに適合するようにシリコンの電気的特性を変更するドーピング剤として BBr3 を積極的に使用しています。
- ガス検知: BBr3 はアンモニアなどの特定のガスと積極的に反応するため、検知や監視の目的で使用されるガス検知器やセンサーに適しています。
- 実験用試薬: BBr3 は、さまざまな実験や研究において試薬として積極的に機能し、臭素化反応を実行し、合成化学における臭素原子の供給源として機能します。
- 医薬品合成: 製薬業界は、特定の薬剤および医薬品中間体の合成に BBr3 を積極的に使用しています。
臭化ホウ素は腐食性と反応性があるため、適切な安全手順に従って慎重に取り扱うことが重要です。
質問:
Q: 三臭化ホウ素 (BBr3) の反応性を表す用語は何ですか?
答え: とても丁寧な対応です。
Q: 三臭化ホウ素の式は何ですか?
A: 臭化ホウ素の式は BBr3 です。
Q: 3.24 グラムの三臭化ホウ素にはホウ素原子がいくつ含まれていますか?
A: 3.24 グラム中に 0.053 モルの BBr3 が含まれており、これは 0.159 モルのホウ素、つまり約 9.62 x 10^22 原子に相当します。
Q: 3.49 グラムの臭素から何グラムの三臭化ホウ素が製造できますか?
A: BBr3 のモル質量は 250.60 g/mol です。したがって、約 3.49 グラムの臭素から約 3.34 グラムの臭化ホウ素が生成されます。
Q: 式 BBr3 の化合物の名前は何ですか?
A: 式 BBr3 の化合物は臭化ホウ素と呼ばれます。
Q: 三臭化ホウ素は極性ですか、それとも無極性ですか?
A: 臭化ホウ素は極性化合物です。
Q: BBr3 の電子幾何学は何ですか?
A: BBr3 の電子幾何学構造は平面三角形です。
Q: BBr3 のルイス構造は何ですか?
A: BBr3 のルイス構造では、中心にホウ素原子が 1 つあり、その周囲に 3 つの臭素原子が取り囲まれています。
Q: BBr3 にはピークがいくつありますか?
A: 臭化ホウ素 (BBr3) は、NMR スペクトルにピークを持っています。
