ヨウ化水素酸 (HI) は、水素とヨウ素から形成される強酸です。有機合成や還元剤として使用されます。非常に腐食性が高く、慎重な取り扱いが必要です。
| IUPAC名 | ヨウ化水素酸 |
| 分子式 | こんにちは |
| CAS番号 | 10034-85-2 |
| 同義語 | ヨウ化水素酸、ヨウ化水素、ヨウ素 |
| インチチ | InChI=1S/HI/h1H |
ヨウ化水素酸の性質
ヨウ化水素酸の処方
ヨウ化水素の化学式はHIです。ヨウ素 (I) 原子に結合した水素 (H) 原子から構成されます。この簡単な式は、この強酸の組成を表しています。
ヨウ化水素酸のモル質量
ヨウ化水素 (HI) のモル質量は、1 モルあたり約 127.91 グラム (g/mol) です。この値は、水素原子とヨウ素原子の原子量を加算して計算されます。
ヨウ化水素酸の沸点
ヨウ化水素の沸点は比較的低く、摂氏 -35 度 (華氏 -31 度) 程度です。この温度では、HI の液体状態は気体状態に変化します。
ヨウ化水素酸 融点
ヨウ化水素の融点は約摂氏 -51 度 (華氏 -60 度) です。この温度では、固体の HI が液体の状態に変わります。
ヨウ化水素酸の密度 g/mL
ヨウ化水素の密度は約 2.85 グラム/ミリリットル (g/mL) です。この密度測定は、物質 1 ミリリットル中に存在する HI の質量を示します。
ヨウ化水素酸 分子量
ヨウ化水素の分子量は約 127.91 g/mol です。この値は、HI 分子内の水素とヨウ素の原子量の合計です。
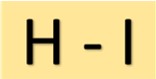
ヨウ化水素酸の構造
ヨウ化水素酸 (HI) は単純な構造をしています。それは、単共有結合によってヨウ素原子に結合した水素原子から構成されます。この分子配置により、HI に特有の特性が与えられます。
ヨウ化水素酸の溶解度
ヨウ化水素酸は水への溶解度が高いです。水と混合すると容易に溶解し、無色の溶液を形成します。溶解性が高いため、化学合成をはじめとするさまざまな用途に広く使用されています。
| 外観 | 無色の液体 |
| 比重 | 2.85g/ml |
| 色 | 無色 |
| 匂い | エーカー |
| モル質量 | 127.91 g/モル |
| 密度 | 2.85g/ml |
| 融合点 | -51°C (-60°F) |
| 沸点 | -35°C (-31°F) |
| フラッシュドット | 適用できない |
| 水への溶解度 | 混和性があり、無色の溶液を形成します |
| 溶解性 | 有機溶剤に可溶 |
| 蒸気圧 | 利用不可 |
| 蒸気密度 | 利用不可 |
| pKa | -十 |
| pH | 非常に酸性(pH < 1) |
ヨウ化水素酸の安全性と危険性
ヨウ化水素 (HI) は腐食性があるため、安全性に重大なリスクが生じます。接触すると重度の皮膚火傷や目の損傷を引き起こす可能性があります。その蒸気を吸入すると呼吸器官への刺激を引き起こします。 HI を取り扱うときは、手袋やゴーグルなどの適切な保護具を使用する必要があります。換気の良い場所で、不適合物質から離れた場所に保管する必要があります。誤って飲み込んだり、吸入した場合は、直ちに医師の診察を受けてください。こぼれた場合は、適切な薬剤で中和し、危険廃棄物として処分してください。事故や怪我を避けるために、厳格な安全プロトコルに従い、慎重に取り扱うことが不可欠です。
| ハザードシンボル | 腐食性 |
| セキュリティの説明 | 重度の皮膚火傷や目の損傷を引き起こします。吸入すると有害。 |
| 国連識別番号 | UN1787 |
| HSコード | 28111990 |
| 危険等級 | 8 (腐食性物質) |
| 梱包グループ | Ⅱ |
| 毒性 | 非常に有毒です |
ヨウ化水素酸の合成方法
ヨウ化水素 (HI) はさまざまな方法で合成できます。一般的なアプローチには、ヨウ素 (I2) と赤リン (P) の直接反応が含まれます。この方法では、I2 が還元剤として作用する赤リンと混合されます。この反応は水の存在下で起こり、HI とリン酸が得られます。
別の方法には、ヨウ素とヒドラジン水和物(N2H4・H2O) の反応が含まれます。ヒドラジン水和物は潜在的に危険な性質を持っているため、このプロセスでは慎重な取り扱いが必要です。反応により、HI と窒素ガスが生成されます。
あるいは、ヨウ素と濃硫酸 (H2SO4)の反応でも HI が生成されます。この方法では、ヨウ素を濃硫酸と混合すると HI ガスが生成され、これを収集して液体の形に凝縮できます。
ヨウ化水素の合成は、適切な安全対策を講じて実行する必要があることに注意することが重要です。含まれる化学物質は危険である可能性があり、反応により有毒ガスが発生する可能性があります。ヨウ化水素の安全かつ成功した製造を確保するには、合成プロセス中に適切な換気、保護具、および安全上の注意事項を遵守することが重要です。
ヨウ化水素酸の用途
ヨウ化水素 (HI) は、その独特の特性により、さまざまな産業でさまざまな用途に使用されています。以下に主な用途をいくつか示します。
- 有機合成: 有機化学では、ハロゲン化アルキルをアルカンに変換するための必須の反応物として HI が使用されます。このプロセスは脱ハロゲン化として知られています。
- 製薬産業: HI に関連する、医療画像用のヨウ素含有薬剤やヨウ素化造影剤などのさまざまな医薬化合物の製造。
- 還元剤: HI は化学反応において強力な還元剤として積極的に機能し、金属イオンの元素形態への還元を助けます。
- 触媒作用: HI は特定の化学反応に触媒として積極的に関与し、反応速度を高め、特定の変換の収率を向上させます。
- 洗浄とエッチング: エレクトロニクスおよび半導体産業では、金属や金属酸化物を溶解する能力があるため、洗浄およびエッチング プロセスに HI が積極的に使用されています。
- 分析化学: 分析化学におけるヨウ素滴定では、HI を積極的に使用して、ヨウ素との反応に基づいて特定の物質の濃度を決定します。
- 金属表面処理:HIは、めっき、ろう付け、その他の表面処理プロセスのための金属表面を準備する役割を積極的に果たしています。
- ヨウ化物の製造: さまざまな業界が HI を積極的に利用して、写真、医療、有機合成などの分野でさまざまな用途に使用されるヨウ化物化合物を製造しています。
- 実験室用試薬: 実験室では、多くの化学反応や実験に有用な試薬として HI を積極的に使用しています。
ヨウ化水素の多彩な特性により、ヨウ化水素は化学研究、工業プロセス、医薬品開発における貴重なツールとなり、複数の分野の進歩や科学的発見に貢献します。
質問:
Q: ヨウ化水素酸 (HI) の酸性特性を中和するには、どのような化合物を加えることができますか?
A: 水酸化ナトリウム (NaOH) などの塩基を添加すると、ヨウ化水素を中和し、水と塩を形成できます。
Q: ヨウ化水素酸は強酸ですか?
A: はい、ヨウ化水素は強酸です。つまり、水中で完全にイオン化し、水素イオンを放出します。
Q: ヨウ化水素酸の式は何ですか?
A: ヨウ化水素の式は HI で、ヨウ素原子に結合した水素原子を表します。
Q: ヨウ化水素酸の式は次のうちどれですか?
A: ヨウ化水素の式は HI です。
Q: 10.00 ml の 0.217 M CsOH と反応するには、何ミリリットルの 0.550 M ヨウ化水素酸が必要ですか?
A: 10.00 mlの0.217 M CsOHと反応するには、約17.58 mlの0.550 M ヨウ化水素が必要です。
Q: ヨウ化水素酸は違法ですか?
A: ヨウ化水素自体は違法ではありませんが、潜在的な危険性や違法行為への応用のため、使用や所持が規制される場合があります。
Q: ヨウ化水素と硫化マグネシウムは何を生成しますか?
A: ヨウ化水素と硫化マグネシウムが反応して、硫化水素 (H2S) ガスとヨウ化マグネシウム塩 (MgI2) が生成されます。
Q: ヨウ化水素と重曹を混合するとどうなりますか?
A: ヨウ化水素が重曹(重炭酸ナトリウム)と反応すると、二酸化炭素、水、ヨウ化ナトリウムが生成されます。
Q: ヨウ化水素は水中でどのように作用しますか?
A: ヨウ化水素は水中でイオン化し、水素イオン (H+) とヨウ化物イオン (I-) を放出し、非常に酸性の溶液になります。
Q: 水酸化ナトリウムとヨウ化水素の正味のイオン反応式は?
A: 水酸化ナトリウム (NaOH) とヨウ化水素 (HI) の反応の正味のイオン方程式は、Na+ + OH- + H+ + I- → Na+ + I- + H2O です。
