チオ硫酸カリウム (K2S2O3) は、還元剤として、またプールの塩素を中和するために写真撮影に使用される化合物です。白色の結晶の外観を持ち、水に溶けます。
| IUPAC名 | チオ硫酸カリウム |
| 分子式 | K2S2O3 |
| CAS番号 | 10294-66-3 |
| 同義語 | 次亜硫酸カリウム、チオ硫酸カリウム、チオ硫酸カリウム五水和物、チオ硫酸カリウム五水和物、スルフロチオ酸カリウム、スルフロチオ酸カリウム |
| インチチ | InChI=1S/2K.H2O3S2/c;;1-4(2)3/h;;(H2,1,2,3)/q2*+1;/p-2 |
チオ硫酸カリウムの性質
チオ硫酸カリウムの処方
チオ硫酸カリウム (K2S2O3) の化学式は、化合物に存在する原子の数と種類を示します。この式は、2 つのカリウム原子、2 つの硫黄原子、3 つの酸素原子で構成されます。カリウム原子はプラスの電荷を持ち、硫黄原子と酸素原子はマイナスの電荷を持ちます。
チオ硫酸カリウム モル質量
K2S2O3 のモル質量は 190.33 g/mol です。モル質量は物質 1 モルの質量であり、化学式内のすべての原子の原子質量を加算することによって計算されます。 K2S2O3 の場合、式は 2 つのカリウム原子、2 つの硫黄原子、3 つの酸素原子で構成されます。
チオ硫酸カリウムの沸点
K2S2O3 は沸点に達する前に分解するため、沸点を持ちません。温度が約100℃に達すると分解が起こり、二酸化硫黄が放出されます。したがって、この化合物は通常、高温用途には使用されません。
チオ硫酸カリウムの融点
K2S2O3の融点は48.3℃です。この温度は他の化合物に比べて比較的低いです。この温度まで加熱すると、固体の K2S2O3 が液体になります。
チオ硫酸カリウムの密度 g/mL
K2S2O3 の密度は 1.667 g/mL です。密度は、特定の体積に含まれる質量の量の尺度です。この値は、1 ミリリットルの K2S2O3 の質量が 1.667 グラムであることを意味します。
チオ硫酸カリウムの分子量
K2S2O3 の分子量は 190.33 g/mol です。分子量は、化合物内のすべての原子の原子量の合計です。物質のモルとグラムを変換するためによく使用されます。
チオ硫酸カリウムの構造
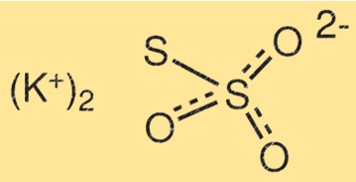
K2S2O3 の構造は、2 つのカリウム原子、2 つの硫黄原子、および 3 つの酸素原子で構成されています。硫黄原子は二重結合によって互いに結合されており、もう一方の硫黄原子は酸素原子の 1 つと結合しています。カリウム原子は残りの酸素原子と結合します。
チオ硫酸カリウムの溶解度
K2S2O3 は水への溶解度が高く、20℃での溶解度は 432 g/L です。このため、水処理や写真の定着剤として効果的な化合物となります。ただし、エタノールやアセトンなどの有機溶媒には溶けません。
| 外観 | 白色の結晶固体 |
| 比重 | 1,667 |
| 色 | 無色~白色 |
| 匂い | 無臭 |
| モル質量 | 190.33 g/モル |
| 密度 | 1,667g/mL |
| 融合点 | 48.3℃ |
| 沸点 | 沸騰する前に分解してしまう |
| フラッシュドット | 適用できない |
| 水への溶解度 | 非常に溶けやすい(20℃で432 g/L) |
| 溶解性 | 有機溶剤に不溶 |
| 蒸気圧 | 適用できない |
| 蒸気密度 | 適用できない |
| pKa | 適用できない |
| pH | 6.0~9.0(5%水溶液) |
チオ硫酸カリウムの安全性と危険性
K2S2O3 は一般に、適切な予防措置を講じた場合、安全に取り扱い、使用できると考えられています。ただし、この化合物に関連する潜在的な危険性を認識しておくことが重要です。 K2S2O3 の粉塵や蒸気にさらされると、目、皮膚、呼吸器系に炎症を引き起こす可能性があります。この化合物を摂取すると、吐き気、嘔吐、下痢を引き起こす可能性もあります。さらに、この化合物と接触すると、人によっては皮膚炎や皮膚感作を引き起こす可能性があります。他の化学物質と同様に、K2S2O3 を取り扱うときは、暴露を避け、事故のリスクを軽減するために、適切な安全手順に従うことが重要です。
| ハザードシンボル | XI |
| セキュリティの説明 | S22 – 粉塵を吸い込まないでください。 S24/25 – 皮膚や目との接触を避けてください。 S37/39 – 適切な手袋と目/顔の保護具を着用してください。 |
| 国連識別番号 | 国連 3077 |
| HSコード | 2832.10.00 |
| 危険等級 | 9 – その他の危険物 |
| 梱包グループ | Ⅲ |
| 毒性 | LD50 (経口、ラット): 2,500 mg/kg |
チオ硫酸カリウムの合成方法
K2S2O3は、アルカリ金属水酸化物の存在下での硫黄と亜硫酸カリウムの反応など、さまざまな方法で合成できます。
別の方法には、水酸化カリウムと硫黄および二酸化硫黄ガスとの反応が含まれます。この反応では、副生成物として K2S2O3 と硫酸カリウムが生成されます。
別の合成方法には、水溶液中での亜硫酸カリウムとチオ硫酸ナトリウムの反応が含まれます。得られた沈殿物を濾過して洗浄すると、純粋な K2S2O3 が得られます。
実験室で K2S2O3 を調製するには、水酸化カリウムを硫黄と反応させ、混合物に二酸化硫黄ガスを加えます。得られた生成物は白色の結晶性固体であり、再結晶によってさらに精製できます。
チオ硫酸カリウムの用途
K2S2O3 は、さまざまな業界でいくつかの重要な用途があります。最も一般的なアプリケーションのいくつかを次に示します。
- 写真: チオ硫酸カリウムは、写真処理の定着剤として使用され、未使用のハロゲン化銀を除去し、画像の退色を防ぎます。
- 農業: チオ硫酸カリウムは、成長と発育に重要な栄養素である硫黄とカリウムを植物に提供する肥料として使用されます。
- 水処理: チオ硫酸カリウムは、プールやスパの水から塩素を除去するだけでなく、産業廃水処理における塩素の影響を中和するために使用されます。
- 分析化学: チオ硫酸カリウムは、分析化学においてヨウ素やその他の酸化剤の濃度を測定するための還元剤として使用されます。
- 医療処置: チオ硫酸カリウムは、シアン化物中毒の治療など、一部の医療処置に使用されています。
- 産業用途: チオ硫酸カリウムは、電気メッキ、革なめし、油抽出などのさまざまな産業用途に使用されます。
質問:
Q: チオ硫酸カリウム還元剤かどうかはどうやって判断しますか?
A: K2S2O3 は、他の分子またはイオンに電子を与え、それらの酸化状態を下げる能力があるため、還元剤です。
Q: チオ硫酸カリウムが還元剤となるのはなぜですか?
A: K2S2O3 は、硫酸塩よりも酸化状態が低い硫黄原子を持っているため、他の分子またはイオンに電子を供与し、還元剤として機能します。
Q: チオ硫酸カリウムは緑色の野菜を燃やしますか?
A: いいえ、K2S2O3 は緑を燃やしません。それは白色の結晶性固体であり、緑色の着色を示さない。
Q: 1.0 M K2S2O3 における AgCl のモル溶解度はどれくらいですか?
A: 1.0 M K2S2O3 における AgCl のモル溶解度は、温度やイオン強度などのさまざまな要因に依存します。追加情報がなければ正確な値を決定することはできません。
Q: 2 (K2S2O3) の K の電荷または酸化数は何ですか?
A: 2 (K2S2O3) の K の電荷または酸化数は +1 です。
Q: K2S2O3 の S の酸化状態は何ですか?
A: K2S2O3 の S の酸化状態は +2 です。
Q: 4 モルの K2S2O3 には何個の分子がありますか?
A: 4 モルの K2S2O3 には約 4 x 6.022 x 10^23 分子の K2S2O3 が含まれており、これは 2.409 x 10^24 分子に相当します。
Q: 4 モルの K2S2O3 はいくらですか?
A: 4 モルの K2S2O3 の質量は、K2S2O3 のモル質量 (190.31 g/mol) に 4 を掛けることで計算できます。これは 761.24 グラムに相当します。したがって、4 モルの K2S2O3 は 761.24 グラムに相当します。
