シュウ酸は、多くの野菜や果物に含まれる無色無臭の有機化合物です。金属の洗浄や研磨など、さまざまな工業プロセスで使用されています。大量に摂取すると有害になる可能性もあります。
| IUPAC名 | エタン二酸 |
| 分子式 | C2H2O4 |
| CAS番号 | 144-62-7 |
| 同義語 | エタン二酸、糖酸、シュウ酸、木材漂白剤、スイバ酸、C2ジカルボン酸など |
| インチチ | InChI=1S/C2H2O4/c3-1(4)2(5)6/h(H,3.4)(H,5.6) |
シュウ酸の性質
シュウ酸の配合
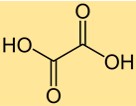
シュウ酸の化学式は C2H2O4 です。 2つの炭素原子、2つの酸素原子、4つの水素原子で構成されています。シュウ酸の式は、サンプル中のシュウ酸の分子量やモル数の決定など、多くの化学計算において重要です。この式は、分子内に存在する原子の比率に関する情報も提供します。
シュウ酸のモル質量
エタン二酸のモル質量は 90.03 g/mol です。これは、分子内に存在する各元素の原子量 (炭素原子 2 個、酸素原子 2 個、水素原子 4 個) を加算することによって計算されます。エタン二酸のモル質量は、特定の反応に必要なエタン二酸の量やエタン二酸溶液の濃度の決定など、多くの化学計算において重要です。
シュウ酸の沸点
エタン二酸の沸点は365℃です。この温度では、エタン二酸の液相は蒸気相に変化し、気体になります。エタン二酸の沸点は、圧力、純度、不純物の存在などのさまざまな要因の影響を受けます。シュウ酸は高温では比較的安定ですが、長時間熱にさらされると分解して二酸化炭素と水が生成される可能性があります。
シュウ酸の融点
エタン二酸の融点は189~191℃です。これは、固体のエタン二酸が液化して液体になり始める温度です。エタン二酸の融点は、純度、圧力、結晶構造などのさまざまな要因の影響を受ける可能性があります。融点は、エタン二酸のさまざまな用途への適合性を判断するのに役立つため、エタン二酸の重要な物理的特性です。
シュウ酸の密度 g/ml
エタン二酸の密度は 1.90 g/ml です。これは、1 ミリリットルのエタン二酸の重さが 1.90 グラムであることを意味します。エタン二酸の密度は、溶液の温度、圧力、濃度に応じて変化します。エタン二酸の密度は、反応に必要なエタン二酸の量の決定や溶液の体積の計算など、多くの化学および工業プロセスで使用される重要な特性です。
シュウ酸の分子量
エタン二酸の分子量は 90.03 g/mol です。これは、分子内のすべての原子の原子量の合計です。エタン二酸の分子量は、特定のサンプル中のエタン二酸のモル数やエタン二酸溶液の濃度の決定など、さまざまな化学計算に使用されます。
シュウ酸の構造
シュウ酸は、中心の炭素原子に 2 つのカルボキシル基 (-COOH) が結合したジカルボン酸構造を持っています。分子は平面構造をしており、2つのカルボキシル基が垂直に配向しています。シュウ酸の構造により、シュウ酸は溶液中で 2 つのプロトンを供与できる強力な有機酸になります。
| 外観 | 白色の結晶性粉末 |
| 比重 | 1.90 g/mL(20℃) |
| 色 | 無色 |
| 匂い | 無臭 |
| モル質量 | 90.03g/モル |
| 密度 | 1.90 g/mL(20℃) |
| 融合点 | 189~191℃ |
| 沸点 | 365℃ |
| フラッシュドット | 適用できない |
| 水への溶解度 | 90g/L(20℃) |
| 溶解性 | 水、アルコール、エーテル、グリセロールに可溶 |
| 蒸気圧 | 0.0001 mmHg(25℃) |
| 蒸気密度 | 3.3 (空気=1) |
| pKa | pKa1=1.25、pKa2=4.14 |
| pH | 1.2 (0.1M溶液) |
シュウ酸の安全性と危険性
シュウ酸は、適切に扱わないと有害な可能性がある危険な物質です。皮膚、目、呼吸器系に対して腐食性があり、接触すると炎症や火傷を引き起こす可能性があります。エタン二酸の粉塵や蒸気を吸入すると、呼吸器への刺激や肺の損傷を引き起こす可能性があります。エタン二酸を取り扱うときは、手袋、ゴーグル、呼吸用保護具などの適切な個人用保護具を着用することが重要です。さらに、熱源や発火源から離れた、涼しく乾燥した場所に保管する必要があります。エタン二酸の廃棄は、地域の規制に従って行う必要があります。
| ハザードシンボル | T、C |
| セキュリティの説明 | 皮膚や目との接触を避けてください。適切な保護服、手袋、目/顔の保護具を着用してください。目に入った場合は、直ちに多量の水で洗い流し、医師の診察を受けてください。事故が発生した場合、または気分が悪くなった場合は、直ちに医師の診察を受けてください(可能であればラベルを提示してください)。 |
| AN識別子 | UN3261 |
| HSコード | 291711 |
| 危険等級 | 8 |
| 梱包グループ | Ⅲ |
| 毒性 | 経口 LD50: 750 mg/kg (ラット)、経皮 LD50: 1000 mg/kg (ウサギ)、吸入 LC50: 1100 ppm/8h (ラット) |
シュウ酸の合成法
シュウ酸(エタン二酸)を合成するには、炭水化物の酸化、エチレングリコールの酸化、一酸化炭素と水酸化ナトリウムの反応など、いくつかの方法があります。
最も一般的な方法の 1 つは、硝酸を使用して炭水化物を酸化することです。炭水化物の加水分解により単糖が生成され、これを硝酸と五酸化バナジウムなどの触媒を使用して酸化します。得られた混合物を炭酸カルシウムで処理した後、硫酸で処理してエタン二酸を放出します。
エタン二酸を合成する別の方法は、硝酸と白金やパラジウムなどの触媒を使用したエチレングリコールの酸化です。エチレングリコールをグリコール酸に酸化し、さらに硝酸と触媒を使用してエタン二酸に酸化します。次に、得られた混合物を炭酸カルシウムと硫酸で処理して、エタン二酸を放出します。
エタン二酸を合成する第 3 の方法には、ニッケルやコバルトなどの触媒の存在下での一酸化炭素と水酸化ナトリウムの反応が含まれます。一酸化炭素と水酸化ナトリウムの反応によりギ酸ナトリウムが生成され、これを水酸化ナトリウムと反応させてシュウ酸ナトリウムが生成されます。シュウ酸ナトリウムを硫酸で処理すると、エタン二酸が放出されます。
シュウ酸の用途
シュウ酸は、その独特の化学的特性により、さまざまな産業でさまざまな用途に使用されています。エタン二酸の一般的な用途をいくつか示します。
- 錆取り:鉄、鋼、銅などの金属表面の錆取り剤として一般的に使用されます。
- 漂白剤: 繊維産業で生地や繊維を白くするために使用されます。
- 木工用:水垢や鉄などの金属による汚れなど、木の汚れを落とすのに使用します。
- 洗浄剤: バスルームやキッチンの備品、カウンタートップ、床などのさまざまな表面の洗浄剤として使用されます。
- キレート剤:セラミックスや医薬品の製造など、さまざまな工業プロセスでキレート剤としても使用されます。
- エッチング液: 電子産業で半導体表面から金属酸化物や不純物を除去するためにエッチング液として使用されます。
- 写真: 特定の種類の写真フィルムの現像剤として写真に使用されます。
- 医療用途: 体内からのカルシウム沈着物の除去や尿路感染症の治療など、一部の医療処置で使用されます。
質問:
Q: 近くでシュウ酸はどこで買えますか?
A: シュウ酸は、多くの金物店、ホームセンター、オンライン小売店で購入できます。化学薬品の専門店でも入手できる場合があります。
Q: 食品中のシュウ酸を中和するにはどうすればよいですか?
A: 牛乳やチーズなどのカルシウムが豊富な物質を添加すると、食品中のシュウ酸を中和できます。カルシウムはシュウ酸と結合し、体への影響を軽減します。
Q: シュウ酸 H2C2O4 の炭素の質量パーセントは何ですか?
A: シュウ酸の分子量は 90.03 g/mol です。エタン二酸 1 モル中の炭素の質量は 24.02 g です。したがって、エタン二酸中の炭素の質量パーセントは、(24.02 g/90.03 g) x 100% = 26.66% となります。
Q: ほうれん草のシュウ酸を減らすにはどうすればよいですか?
A: ほうれん草を食べる前に湯通しすることで、ほうれん草のシュウ酸を減らすことができます。このプロセスでは、ほうれん草を短時間茹でた後、氷水で冷却してエタン二酸の含有量を減らします。
Q: シュウ酸 H2C2O4 の炭素の質量パーセントは何ですか?
A: シュウ酸の分子量は 90.03 g/mol です。エタン二酸 1 モル中の炭素の質量は 24.02 g です。したがって、エタン二酸中の炭素の質量パーセントは、(24.02 g/90.03 g) x 100% = 26.66% となります。
Q: H2C2O4 は酸ですか、それとも塩基ですか?
A: H2C2O4 は酸であり、エタン二酸としても知られています。
Q: H2C2O4 の反応順序は何ですか? A: H2C2O4 の反応順序は、問題の特定の反応によって異なります。これは、初速度法や統合速度法則などの方法を使用して実験的に決定できます。
