クロロスルホン酸は、式 HSO₃Cl を持つ強酸です。非常に腐食性が高く、有機合成の試薬として、また洗剤や染料の製造用のスルホン化剤として使用されます。
| IUPACの名称 | クロロスルホン酸 |
| 分子式 | HSO₃Cl |
| CAS番号 | 7790-94-5 |
| 同義語 | 硫酸クロルヒドリン、クロロ硫酸、クロロスルホン酸 |
| インチチ | InChI=1S/ClHO3S/c1-5(2,3)4/h(H,2,3,4) |
クロロスルホン酸の性質
クロロスルホン酸式
クロロスルホン酸の式は HSO3Cl です。水素原子1個、硫黄原子1個、酸素原子3個、塩素原子1個で構成されています。
クロロスルホン酸モル質量
クロロ硫酸のモル質量は、その構成原子の原子質量を加算することによって計算されます。 HSO3Cl のモル質量は 1 モルあたり約 116.5 グラムです。
クロロスルホン酸の沸点
クロロ硫酸の沸点は比較的高いです。摂氏約 151 度 (華氏 304 度) です。この温度では、クロロ硫酸は液相から気相に変化します。
クロロスルホン酸 融点
クロロ硫酸の融点は約摂氏 -82 度 (華氏 -116 度) です。これは、固体のクロロ硫酸が液体に変わる温度です。
クロロスルホン酸の密度 g/mL
クロロ硫酸の密度は、室温で約 1.75 グラム/ミリリットル (g/mL) です。これは、一定体積のクロロ硫酸が、同体積の水と比較して相対的に重いことを意味します。
クロロスルホン酸の分子量
クロロ硫酸の分子量は、化学式内のすべての原子の原子量を加算することによって計算されます。クロロ硫酸の分子量は 1 モルあたり約 116.5 グラムです。
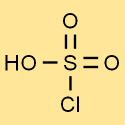
クロロスルホン酸の構造
クロロ硫酸の構造は、3 つの酸素原子と 1 つの塩素原子に結合した 1 つの硫黄原子で構成されています。水素原子は酸素原子の 1 つと結合しています。この構造により、クロロ硫酸に独特の特性と反応性が与えられます。
クロロスルホン酸の溶解度
クロロ硫酸は水によく溶けます。水に容易に溶解し、強酸性の溶液を形成します。クロロ硫酸の溶解度は、その極性と水分子との水素結合の形成によるものです。
| 外観 | 無色~黄色の液体 |
| 比重 | 1.75(20℃にて) |
| 色 | 無色~黄色 |
| 匂い | 強い刺激臭 |
| モル質量 | 116.5g/モル |
| 密度 | 1.75g/mL(20℃にて) |
| 融合点 | -82°C (-116°F) |
| 沸点 | 151°C (304°F) |
| フラッシュドット | 利用不可 |
| 水への溶解度 | 混和性 |
| 溶解性 | クロロホルム、ジクロロメタン、ニトロベンゼンなどの有機溶媒に可溶 |
| 蒸気圧 | 利用不可 |
| 蒸気密度 | 利用不可 |
| pKa | -2.6 |
| pH | 非常に酸性(pH < 1) |
注: この表に示されている値は、クロロ硫酸に関連する一般的な特性であることに留意してください。実際の値は、特定の条件や化合物の純度によって多少異なる場合があります。
クロロスルホン酸の安全性と危険性
クロロ硫酸は安全性に重大なリスクをもたらすため、細心の注意を払って取り扱う必要があります。非常に腐食性が高く、皮膚、目、呼吸器系に接触すると重度の火傷を引き起こす可能性があります。吸入または摂取すると、呼吸困難や内臓の損傷などの重大な健康リスクを引き起こす可能性があります。水と激しく反応し、有毒ガスを発生し、発熱します。有機物質と接触すると、火災や爆発の危険性が存在します。クロロ硫酸を扱う場合は、手袋、ゴーグル、呼吸用保護具などの適切な個人用保護具を使用する必要があります。この危険な物質を取り扱う際の暴露を最小限に抑え、安全を確保するには、適切な換気と封じ込め対策が不可欠です。
| ハザードシンボル | 腐食性 (C)、有害性 (Xn) |
| セキュリティの説明 | – 細心の注意を払って取り扱います\n- 適切な保護具を使用してください\n- 皮膚、目との接触、吸入を避けてください\n- 換気の良い場所に保管してください\n- 水や反応性物質と混合しないでください |
| 国連識別番号 | 国連 1751 |
| HSコード | 28121100 |
| 危険等級 | クラス 8 – 腐食性物質 |
| 梱包グループ | パッキンググループ II |
| 毒性 | 非常に有毒です。重度の火傷や呼吸器損傷を引き起こす |
クロロスルホン酸の合成方法
クロロ硫酸を合成するにはいくつかの方法があります。一般的な方法には、三酸化硫黄 (SO3) と塩化水素 (HCl)の反応が含まれます。このプロセスでは、 HCl溶液に SO3 ガスをバブリングさせてクロロ硫酸を生成します。反応の発熱性が高いため、温度と反応条件を注意深く制御する必要があります。
別の方法では、塩素ガス (Cl2) と硫酸 (H2SO4) の反応によりクロロ硫酸が生成されます。塩素ガスが濃硫酸を通過すると、クロロ硫酸が生成します。安全を確保するには、この発熱反応に対して適切な対策を講じる必要があります。
さらに、クロロ硫酸の調製には、硫酸と塩化スルフリル (SO2Cl2) の反応が含まれます。塩化スルフリルは硫酸と反応してクロロ硫酸と塩化水素ガスを生成します。
クロロ硫酸の合成は、適切な安全プロトコルに従って、設備の整った実験室で実行する必要があることに注意してください。化学者は安全を確保するために、手袋、ゴーグル、フードなどの保護具を使用する必要があります。
これらの合成方法により、化学者は有機合成、スルホン化反応、染料や洗剤の製造など、さまざまな産業用途で使用される多用途化合物であるクロロ硫酸を製造できます。
クロロスルホン酸の用途
クロロ硫酸は、その多用途な特性により、さまざまな産業で幅広い用途に使用されています。その用途の一部を次に示します。
- クロロ硫酸は、エステル化、スルホン化、ハロゲン化などのさまざまな有機合成反応に積極的に関与し、強力な試薬として機能します。官能基を効率的に導入し、分子構造を修飾します。
- クロロ硫酸は芳香族化合物を積極的にスルホン化し、スルホン酸基の生成を可能にするため、染料の製造において重要な役割を果たします。これらの基は染料の溶解性を改善し、色の特性を改善します。
- 洗剤の製造において、クロロ硫酸は洗剤化合物の合成中にスルホン化剤として積極的に機能します。界面活性剤の形成に積極的に寄与し、界面活性剤の洗浄特性と起泡特性を向上させます。
- 製薬業界では、研究および製造の有効成分としてクロロ硫酸が広く使用されています。薬物分子にスルホンアミド基を積極的に導入し、薬理学的特性に大きな影響を与えます。
- 重合反応では、特殊なポリマーの合成のための触媒または開始剤としてクロロ硫酸が積極的に使用されます。これらのポリマーは、コーティング、接着剤、電気絶縁などのさまざまな産業で積極的に用途が見出されています。
- スルホン酸、硫酸エステル、クロロスルホン酸塩などのさまざまな化学物質の製造における重要な中間体として機能します。これらの化合物は、製薬、農薬、ポリマー製造などのさまざまな産業で応用されています。
- 研究室では、研究者はエステル化、アシル化、脱水反応などのさまざまな化学反応の試薬としてクロロ硫酸を積極的に使用しています。
クロロ硫酸は腐食性があり、潜在的な健康リスクがあるため、慎重に取り扱うことが重要です。
質問:
Q: アセトアニリドとクロロスルホン酸からアセトアミドベンゼンスルホニルクロリドを作成するにはどうすればよいですか?
A: アセトアミドベンゼンスルホニルクロリドは、アセトアニリドをクロロ硫酸で処理することによって形成され、アミノ基がスルホニルクロリド基で置換されます。
Q: クロロスルホン酸はどのように使用しますか?
A: クロロ硫酸は、スルホン化、エステル化、アシル化などのさまざまな化学反応において、官能基の導入や分子構造の修飾を行う試薬として使用されます。
Q: クロロスルホン酸は良い脱離基ですか?
A: はい、クロロ硫酸は、スルホン酸基の安定性と置換反応を受ける能力により、優れた脱離基です。
Q: クロロスルホン酸を除去するにはどうすればよいですか?
A: クロロ硫酸は炭酸ナトリウムなどの塩基で中和し、水で希釈して、地域の規制に従って慎重に廃棄する必要があります。
Q: クロロスルホン酸が水と接触するとどうなりますか?
A: クロロ硫酸は水と接触すると激しく反応し、熱と二酸化硫黄や塩化水素などの有毒ガスを発生します。
Q: クロロスルホン酸を別の試薬に置き換えることでラウリル硫酸ナトリウムを調製できますか?
A: はい、ラウリル硫酸ナトリウムは、ラウリルアルコールとの反応においてクロロ硫酸を硫酸に置き換え、その後水酸化ナトリウムで中和することによって合成できます。
Q: クロロスルホン酸の密度はどれくらいですか?
A: クロロ硫酸の密度は室温で約 1.75 g/mL です。
Q: 1 モルのアセトアミドベンゼンスルホニルクロリドを生成するには、何モルのクロロスルホン酸が必要ですか?
A: 1 モルのアセトアミドベンゼンスルホニルクロリドは、1 モルのアセトアニリドと 1 モルのクロロ硫酸を反応させることによって得られます。
Q: クロロスルホン酸は酸化剤と一緒に保存できますか?
A: いいえ、クロロ硫酸は酸化性物質と接触すると激しく反応したり、火災の危険性が高まる可能性があるため、酸化剤とは別に保管する必要があります。
