クロム酸は、金属の洗浄、彫刻、実験室での実験など、さまざまな用途に使用される強力な腐食性酸化剤です。色は赤です。
| IUPAC名 | クロム酸 |
| 分子式 | H2CrO4 |
| CAS番号 | 7738-94-5 |
| 同義語 | クロム(VI)酸、クロム酸、ジヒドロキシジオキシドクロム、二水素(テトラオキシドクロム酸塩) |
| インチチ | InChI=1S/Cr・H2O4/c;1-5(2,3)4/h;(H2,1,2,3,4)/q+2;/p-2 |
クロム酸の性質
クロム酸の配合
クロム酸の化学式は H2CrO4 です。 2 つの水素原子、1 つのクロム原子、4 つの酸素原子で構成されています。この式はクロム酸の組成を分子レベルで表しています。
クロム酸モル質量
クロム酸のモル質量は、その構成元素の原子質量を加算することで計算できます。クロムの原子質量は 1 モルあたり 51.996 グラム、水素のモル質量は 1 モルあたり 1.008 グラム、酸素のモル質量は 1 モルあたり 16.00 グラムです。したがって、クロム酸のモル質量は 1 モルあたり約 118.00 グラムです。
クロム酸の沸点
クロム酸は加熱すると分解して酸素ガスを放出するため、明確な沸点がありません。ただし、分解温度は約 190°C (374°F) です。加熱すると、クロム酸が化学反応を起こし、三酸化クロムと水が生成します。
クロム酸の融点
クロム酸の融点は、融解する前に分解する傾向があるため、明確に定義されていません。ただし、クロム酸は、条件によっては約 250°C (482°F)、またはさらに低い温度で分解する可能性があることが知られています。
クロム酸の密度 g/mL
クロム酸の密度は、室温で約 1.2 グラム/ミリリットル (g/mL) です。この密度値は、クロム酸が水に比べて相対的に密度が高いことを示しています。
クロム酸の分子量
クロム酸の分子量は、その構成元素の原子量を加算して計算されます。この場合、分子量は 1 モルあたり約 118.00 グラムです。
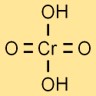
クロム酸の構造
クロム酸の構造は、4 つの酸素原子と 2 つの水素原子に結合した中心のクロム原子によって表されます。クロム原子の周りに酸素原子が四面体状に配置されています。
クロム酸の溶解度
クロム酸は水に中程度に溶けるので、ある程度までは溶けます。溶解度は温度の上昇とともに増加します。ただし、腐食性物質ですので取り扱いには注意が必要です。
| 外観 | 暗赤色の結晶 |
| 比重 | 2.70 |
| 色 | 赤 |
| 匂い | 無臭 |
| モル質量 | 118.01 g/モル |
| 密度 | 1,201g/ml |
| 融合点 | ~190℃で分解 |
| 沸点 | ~250℃で分解 |
| フラッシュドット | 適用できない |
| 水への溶解度 | 可溶性 |
| 溶解性 | 水およびエタノール、エーテルなどの有機溶媒に可溶 |
| 蒸気圧 | 適用できない |
| 蒸気密度 | 適用できない |
| pKa | -0.64 |
| pH | 非常に酸性(pH < 1) |
クロム酸の安全性と危険性
クロム酸はいくつかの安全上のリスクを引き起こすため、慎重に取り扱う必要があります。これは腐食性物質であり、接触すると皮膚、目、呼吸器系に重度の火傷を引き起こす可能性があります。クロム酸の蒸気やミストを吸入すると、気道を刺激し、咳、息切れ、肺損傷を引き起こす可能性があります。また、摂取すると非常に有毒で、腹痛、嘔吐、潜在的な臓器損傷を引き起こします。さらに、クロム酸は強力な酸化剤であり、激しく反応したり、可燃性物質を発火させたりする可能性があります。クロム酸を扱うときは、手袋、ゴーグル、白衣などの適切な保護具を着用し、安全規制に従って保管および廃棄する必要があります。
| ハザードシンボル | 腐食性、酸化性 |
| セキュリティの説明 | – 重度の火傷を引き起こす – 激しい火災の可能性がある。酸化剤 – 飲み込むと有害 – 気道への炎症を引き起こす – 目の損傷を引き起こす – 遺伝的欠陥を引き起こす可能性がある – 癌を引き起こす可能性がある – 生殖能力や胎児にダメージを与える可能性がある – 水生生物に対して非常に有毒 – 正しく取り扱い、処分する |
| 国連識別番号 | UN1755、UN1463 |
| HSコード | 28191000 |
| 危険等級 | 8 (腐食性) |
| 梱包グループ | Ⅱ(中級) |
| 毒性 | 非常に有毒で有害です |
クロム酸の合成法
クロム酸を合成するにはいくつかの方法があります。
一般的な方法には、重クロム酸ナトリウム (Na2Cr2O7) と硫酸 (H2SO4)の反応が含まれます。このプロセスでは、撹拌しながら硫酸に重クロム酸ナトリウムをゆっくりと加えます。反応が進行し、副生成物としてクロム酸 (H2CrO4) と硫酸ナトリウム (Na2SO4) が生成します。得られたクロム酸溶液は、過剰な水を除去することによって精製および濃縮することができる。
前の方法と同様に、クロム酸カリウムを硫酸に添加すると、副生成物としてクロム酸と硫酸カリウム (K2SO4)が生成します。
あるいは、三酸化クロム (CrO3) を水と反応させてクロム酸を調製することもできます。三酸化クロムを水に溶解すると、クロム酸溶液が形成されます。
クロム酸は非常に腐食性が高く危険な物質であることに注意してください。したがって、その合成は適切な安全対策を講じ、換気の良い場所で行う必要があります。合成プロセス中は、手袋、ゴーグル、白衣などの保護具を着用してください。また、合成中に発生する廃棄物の安全な取り扱いと廃棄を確保するために、適切な廃棄方法に従ってください。
クロム酸の用途
クロム酸は強力な酸化剤としての特性により、さまざまな用途に使用されます。一般的な用途は次のとおりです。
- 金属洗浄:クロム酸は金属表面から錆、スケール、有機堆積物を効果的に除去し、表面の汚染物質を洗浄して除去します。
- エッチング: クロム酸は、ガラス、セラミック、金属などの表面に微細なパターンやデザインを作成し、それらをエッチングして装飾ガラス製品の製造や電子回路の製造に役立ちます。
- 表面処理: 工業プロセスでは、クロム酸を使用して塗装、コーティング、または接着用の表面を準備し、不純物を除去してきれいな表面を作成することで良好な接着を確保します。
- 分析化学: 化学者や研究室は、化学分析や実験室での酸化剤としてクロム酸を使用し、特定の有機化合物の濃度を測定します。
- 木材の保存:クロム酸は木材の保存剤として作用し、木材の繊維に深く浸透して、腐敗、昆虫の侵入、風化から木材を保護します。
- 繊維産業: 繊維産業では、染色および印刷プロセスにクロム酸を使用し、布地に染料を固定し、色堅牢度を向上させます。
- 写真: クロム酸は、カラー プリントやカラー リバーサル フィルムの製造など、特定の写真プロセスで役割を果たします。
- 電気めっき: 電気めっきプロセス、特にクロムめっきでは、クロム酸が金属表面に堆積するクロムイオンの供給源として機能し、保護および装飾コーティングを提供します。
クロム酸は危険物質であり、取り扱い、保管、廃棄する際には適切な安全対策を講じる必要があることに注意することが重要です。
質問:
Q: フェノールをクロム酸で酸化するとどうなりますか?
A: フェノールはクロム酸により酸化され、キノンと水が生成されます。
Q:クロム酸はどうやって作るのですか?
A: クロム酸は、重クロム酸ナトリウムまたはクロム酸カリウムを硫酸と反応させることによって調製できます。
Q:クロム酸はどうやって作るのですか?
A: クロム酸は、クロム化合物(三酸化クロムなど)を水と混合することで生成できます。
Q:クロム酸とは何ですか?
A: クロム酸は、クロム、水素、酸素から構成される強力で腐食性の酸化剤です。
Q: クロム酸はアルケンを還元しますか?
A: いいえ、クロム酸は酸化剤であり、還元特性はありません。
Q: 実験用ガラス器具を洗浄するためにクロム酸を準備するにはどうすればよいですか?
A: クロム酸洗浄液は、三酸化クロムを水に溶かし、硫酸を加えて作ることができます。
Q:クロム酸は強酸ですか?
A: はい、クロム酸はプロトンを供与する能力があるため、強酸とみなされます。
Q: クロム酸洗浄液はどのように準備すればよいですか?
A: クロム酸洗浄液を作るには、三酸化クロムを水に溶かし、少量の硫酸を加えます。
Q: 次のアルコールのうち、クロム酸検査で陽性反応が出るものはどれですか?
A: 第一級アルコールはクロム酸検査で陽性反応を示し、オレンジから緑または青への色の変化を引き起こす可能性があります。
