オキシ塩化リン (POCl3) は、さまざまな工業プロセスで使用される化合物です。水と反応してリン酸と塩酸を生成します。
| IUPAC名 | オキシ塩化リン |
| 分子式 | POCl3 |
| CAS番号 | 10025-87-3 |
| 同義語 | 塩化ホスホリル、三塩化ホスホリル、三塩化リン |
| インチチ | InChI=1S/Cl3OP/c1-4(2)3 |
オキシ塩化リンの性質
オキシ塩化リンの配合
塩化ホスホリルの化学式は POCl3 です。リン(P)原子(P と表記)1 つと塩素(Cl)原子(Cl と表記)3 つから構成されており、式は化合物中に存在する各元素の割合を示しています。
オキシ塩化リン モル質量
塩化ホスホリルのモル質量は、構成元素の原子質量を加算することで計算できます。リンのモル質量は 30.97 g/mol ですが、塩素のモル質量は 35.45 g/mol です。塩素のモル質量に 3 を掛け、リンのモル質量を加えると、塩化ホスホリルの総モル質量は約 153.33 g/mol になります。
オキシ塩化リンの沸点
塩化ホスホリルの沸点は約 105.5℃です。この温度は、標準大気圧下で液体化合物が気体状態に変化する温度を表します。沸点は、塩化ホスホリルの取り扱いと用途に影響を与える重要な特性です。
オキシ塩化リン 融点
塩化ホスホリルの融点は約-112.5℃です。これは、固体化合物が液体状態に変化する温度を意味します。融点は、保管および輸送を考慮する上で重要なパラメータです。
オキシ塩化リンの密度 g/mL
塩化ホスホリルの密度は約 1.65 g/mL です。密度とは、物質の単位体積あたりの質量を指します。密度が高いほど、所定の体積内の粒子の濃度が高いことを示します。
オキシ塩化リンの分子量
塩化ホスホリルの分子量は、構成元素の原子量を加算して計算されます。リンの分子量は約 30.97 g/mol ですが、塩素の分子量は 35.45 g/mol です。重量を加えた質量を加算すると、塩化ホスホリルのおよその分子量は 153.33 g/mol になります。
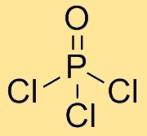
オキシ塩化リンの構造
塩化リンは、3 つの塩素原子と 1 つの酸素原子に 1 つのリン原子が結合した分子構造を持っています。塩素原子は中心のリン原子の周りに対称的に配置され、酸素原子もリン原子に結合しています。この配置により四面体幾何学が形成されます。
オキシ塩化リンの溶解度
塩化ホスホリルは水には溶けにくいですが、ベンゼン、四塩化炭素、クロロホルムなどの有機溶媒にはよく溶けます。その溶解挙動は、分子の極性と、酸素や塩素などの電気陰性原子の存在に起因すると考えられます。
| 外観 | 無色の液体 |
| 比重 | 1,645g/ml |
| 色 | 無色 |
| 匂い | エーカー |
| モル質量 | 153.33 g/モル |
| 密度 | 1,645g/ml |
| 融合点 | -112.5℃ |
| 沸点 | 105.5℃ |
| フラッシュドット | 適用できない |
| 水への溶解度 | 激しく反応する |
| 溶解性 | ベンゼン、四塩化炭素、クロロホルムなどの有機溶媒に可溶 |
| 蒸気圧 | 20℃で11mmHg |
| 蒸気密度 | 5.29 (空気 = 1) |
| pKa | 適用できない |
| pH | 適用できない |
オキシ塩化リンの安全性と危険性
塩化ホスホリルは安全上の問題を引き起こすため、慎重な取り扱いが必要です。皮膚、目、呼吸器系に対して腐食性があります。接触すると重度の火傷や目の損傷を引き起こす可能性があります。その煙や蒸気を吸入すると、気道を刺激することがあります。この化合物を扱うときは、手袋やゴーグルなどの適切な個人用保護具を着用してください。発火源から離れた、換気の良い場所に保管する必要があります。暴露した場合は、直ちに医師の診察が必要です。さらに、有毒な蒸気の放出を避けるために、ドラフト内で取り扱う必要があります。
| ハザードシンボル | 腐食性、危険性 |
| セキュリティの説明 | 腐食性。重度の皮膚火傷や目の損傷を引き起こします。吸入または飲み込むと有害の可能性があります。接触や吸入を避けてください。 |
| 国連識別番号 | 1810年 |
| HSコード | 2812.10.00 |
| 危険等級 | クラス8(腐食性物質) |
| 梱包グループ | 梱包グループ III (軽度の危険) |
| 毒性 | 塩化ホスホリルは有毒であり、深刻な健康影響を引き起こす可能性があります。 |
オキシ塩化リンの合成方法
塩化ホスホリルはさまざまな方法で合成できます。一般的な方法には、三塩化リン (PCl3)と酸素 (O2) の反応が含まれます。このプロセスでは、 PCl3が過剰な酸素の存在下で加熱されて塩化ホスホリルが形成されます。この反応は発熱性であり、通常は反応容器などの制御された環境で発生します。
別の合成方法には、五酸化リン (P2O5)と三塩化リンの反応が含まれます。 P2O5 は脱水剤として作用し、 PCl3と結合すると塩化ホスホリルを形成します。
さらに、塩化ホスホリルは、三臭化リン (PBr3) と五酸化リンの反応によって合成できます。この反応により、塩化ホスホリルと五臭化リンが生成します。
さらに、リンの直接塩素化でも塩化ホスホリルを生成する可能性があります。このプロセスでは、塩素ガスが加熱されたリンの上を通過し、塩化ホスホリルが形成されます。
これらの合成方法は、含まれる化合物の反応性と危険な性質のため、注意して実行する必要があることに注意することが重要です。塩化ホスホリルの安全な取り扱いと合成を確保するには、保護具の使用や制御された反応条件などの適切な安全プロトコルに従う必要があります。
オキシ塩化リンの用途
塩化ホスホリルは、その独特の特性により、さまざまな産業でさまざまな用途に使用されています。一般的な用途は次のとおりです。
- 化学合成: 有機化学では、ホスホン酸、エステル、アミドなどのさまざまな化合物を製造するための多用途試薬として塩化ホスホリルが広く使用されています。
- 農薬: 作物保護および害虫駆除における殺虫剤および除草剤の合成は、主要成分としての塩化ホスホリルに関連しており、重要な役割を果たしています。
- 製薬産業: 医薬品中間体および医薬品有効成分 (API) の製造には塩化ホスホリルが使用され、抗マラリア薬や抗炎症薬などの重要な薬剤の合成が容易になります。
- ポリマー産業: ポリマーの製造において、塩化ホスホリルは触媒および塩素化剤として機能し、材料の耐火性を向上させる難燃性添加剤の合成に貢献します。
- 染料と顔料の製造: 塩化ホスホリルは、染料と顔料の製造、特に繊維、インク、コーティングに使用される染料の開発に不可欠な化合物であるクロロアルキルホスホネートの製造に用途が見出されます。
- 実験室試薬: アルコールの塩化アルキルへの変換やリン酸化剤の調製など、さまざまな実験室手順で試薬として塩化ホスホリルが使用されます。
- 水処理: 水処理プロセスでは、pH レベルを制御し、不純物を除去するために、酸性化剤および消毒剤として塩化ホスホリルを使用します。
- 難燃剤: 塩化ホスホリルは難燃性材料の製造に役割を果たし、繊維、プラスチック、建築材料の防火特性を向上させます。
これらの多様な用途は、多くの産業分野における塩化ホスホリルの重要性を示しており、化学合成、農業、製薬および材料科学における塩化ホスホリルの重要な役割を強調しています。
質問
Q: POCl3 の分子構造は何ですか?
A: POCl3 の分子構造は三角錐形です。
Q: 化合物 A が POCl3 とピリジンで脱水されるときに形成される主なアルケンは何ですか?
A: POCl3 およびピリジンによる化合物 A の脱水中に形成される主なアルケンは、化合物 A の特定の構造に依存します。
Q: POCl3 は極性ですか、それとも無極性ですか?
A: POCl3 は極性結合の存在と非対称な分子形状により極性分子です。
Q: POCl3 ガスはどのくらい発生しますか?
A: 生成される POCl3 ガスの量は、反応物の量と特定の反応条件によって異なります。
Q: 10.0 グラムの POCl3 には何モルの POCl3 が含まれますか?
A: 10.0 グラムの POCl3 中には約 0.082 モルの POCl3 が含まれています。
Q: POCl3 の P の電子対の構造は何ですか?
A: POCl3 の P の電子対の形状は四面体です。
Q: POCl3 には双極子モーメントがありますか?
A: はい、POCl3 には極性結合の存在とその分子構造により双極子モーメントがあります。
Q: POCl3 には共鳴がありますか?
A: いいえ、POCl3 は非局在電子や多重共鳴構造がないため、共鳴を示しません。
Q: POCl3 の酸素原子の周囲の電子ドメインの幾何学的形状は何ですか?
A: POCl3 の酸素原子の周囲の電子ドメインの形状は三角錐形です。
Q: 72.3 ミリリットルの POCl3 が完全に反応すると、どのくらいの体積の H3PO4 が形成されますか?
A: 72.3 ミリリットルの POCl3 が反応するときに生成される H3PO4 の体積は、反応の化学量論に完全に依存し、提供された情報だけから判断することはできません。
