アセトフェノンまたはメチルフェニルケトンは、式 C8H8O の芳香族有機化合物です。香料や樹脂の製造、医薬品の溶媒や中間体として使用されます。
| IUPAC名 | 1-フェニルエタノン |
| 分子式 | C8H8O |
| CAS番号 | 98-86-2 |
| 同義語 | メチルフェニルケトン、フェニルメチルケトン、AP、アセチルベンゼン、ベンゾイルメチル、エチルフェニルケトン、ヒプノン |
| インチチ | InChI=1S/C8H8O/c1-7(9)8-5-3-2-4-6-8/h2-6H,1H3 |
アセトフェノンの構造
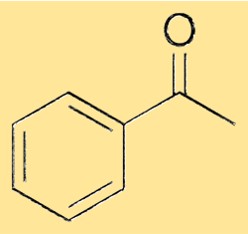
アセトフェノンの構造は、単結合を介してカルボニル基に結合したフェニル基から構成されます。カルボニル基は、酸素原子に二重結合した炭素原子から構成されます。フェニル基は、5 つの水素原子が結合した炭素原子の 6 員環で、6 位はカルボニル炭素原子で占められています。この構造によりアセトフェノンに特有の特性が与えられ、アセトフェノンがさまざまな化学物質を合成するための多用途の原料として機能することが可能になります。
アセトフェノンの融点
アセトフェノンの融点は-15.7℃です。融点は、一定の圧力下で固体が液体に変わる温度です。アセトフェノンは室温で結晶固体であり、他の同様の化合物と比較して比較的低い融点を持っています。化合物の融点は、その分子構造と分子間力の強さによって決まります。
アセトフェノンのIRスペクトル
アセトフェノンのIRスペクトルは、カルボニル基に相当する1705cm^-1と、芳香族CHの伸縮に相当する3030〜3100cm^-1に特徴的なピークを示します。これらのピークは、分子内に存在する官能基に関する重要な情報を提供します。
アセトフェノンのモル質量:
アセトフェノンのモル質量は 120.15 g/mol です。フェニル環にカルボニル基が結合した芳香族有機化合物です。モル質量は、化合物 1 モルに含まれる原子の原子質量の合計です。アセトフェノンの場合、分子内に炭素原子が 8 個、水素原子が 8 個、酸素原子が 1 個あり、合計 17 個の原子が含まれています。モル質量は、化学や産業のさまざまな用途に必要な、特定のサンプル内の物質の量を計算するために使用されるため、化合物の重要な特性です。
アセトフェノンの沸点
アセトフェノンの沸点は202℃です。沸点とは、一定の圧力下で液体が気体に変化する温度です。アセトフェノンは揮発性有機化合物であり、他の同様の化合物と比較して比較的高い沸点を持っています。化合物の沸点は、分子間力の強さによって決まります。分子間力とは、液体または固体の状態で分子を保持する力です。アセトフェノンの場合、他のアセトフェノン分子と水素結合を形成できる極性カルボニル基を持っており、これにより分子間力が強化され、沸点が上昇します。
メチルフェニルケトンの密度 g/ml
メチルフェニルケトンの密度は室温で 1.03 g/mL です。密度は単位体積あたりの物質の質量です。メチルフェニルケトンは室温で液体であり、他の同様の化合物と比較して比較的高い密度を持っています。化合物の密度は、その分子量と所定の体積内の分子の密度によって決まります。メチルフェニルケトンの場合、分子量が比較的高く、分子構造が比較的コンパクトであるため、分子のパッキングがより効率的になり、密度が増加します。
メチルフェニルケトンの分子量
メチルフェニルケトンの分子量は 120.15 g/mol です。分子量は、分子内のすべての原子の原子量の合計です。メチルフェニルケトンは、分子内に 8 個の炭素原子、8 個の水素原子、1 個の酸素原子を持ち、合計 17 個の原子を持ちます。分子量は、化学や産業のさまざまな用途に必要な、特定のサンプル内の物質の量を計算するために使用されるため、化合物の重要な特性です。
| 外観 | 無色~淡黄色の液体 |
| 比重 | 25℃で1.028~1.031 |
| 色 | 無色~淡黄色 |
| 匂い | 甘い、花のような、蜂蜜のような香り |
| モル質量 | 120.15 g/モル |
| 密度 | 1.03 g/mL(25℃) |
| 融合点 | -15.7℃ |
| 沸点 | 202℃ |
| フラッシュドット | 78℃ |
| 水への溶解度 | 3.3 g/L(25℃) |
| 溶解性 | アルコール、エーテル、クロロホルム、ベンゼンに可溶 |
| 蒸気圧 | 0.27 mmHg(25℃) |
| 蒸気密度 | 4.15 (空気 = 1) |
| pKa | 10.01 |
| pH | 該当なし(メチルフェニルケトンは酸でも塩基でもない) |
メチルフェニルケトンの安全性と危険性
メチルフェニルケトンは正しく取り扱わないと危険です。接触または吸入すると、皮膚、目、呼吸器系に炎症を引き起こす可能性があります。高濃度のメチルフェニルケトン蒸気に直接さらされると、頭痛、めまい、吐き気を引き起こす可能性があります。メチルフェニルケトンを摂取すると、胃腸の炎症、嘔吐、下痢を引き起こす可能性があります。メチルフェニルケトンも引火性があり、空気と爆発性混合物を形成する可能性があります。発火源から離れた、涼しく乾燥した換気の良い場所に保管する必要があります。メチルフェニルケトンを取り扱うときは、手袋、安全メガネ、マスクなどの個人用保護具を着用する必要があります。
| ハザードシンボル | Xi:刺激性、F:引火性が高い |
| セキュリティの説明 | S16: 発火源から遠ざける – 喫煙しないでください、S26: 目に入った場合は、すぐに多量の水で洗い流し、医師に相談してください、S36: 適切な保護服を着用してください、S37: 適切な手袋を着用してください、S39: 適切な着用してください防護服。顔の保護 |
| 国連識別番号 | 国連 2319 |
| HSコード | 291439 |
| 危険等級 | 3 (引火性液体) |
| 梱包グループ | Ⅲ |
| 毒性 | メチルフェニルケトンは、カテゴリー 3 の眼刺激性物質およびカテゴリー 4 の皮膚刺激性物質として分類されています。発がん性物質や変異原性とはみなされていません。ラットの経口 LD50 (試験対象の 50% の致死量) は約 3,000 mg/kg です。重大な環境リスクとはみなされません。 |
メチルフェニルケトンの合成方法
メチルフェニルケトンを合成するにはさまざまな方法が存在します。
一般的な方法は、塩化アルミニウムなどのルイス酸触媒の存在下での塩化アセチルによるベンゼンのフリーデルクラフツアシル化です。この反応では、メチルフェニルケトンと塩化水素が副生成物として生成されます。
別の方法は、コバルトやマンガンなどの金属触媒の存在下で空気または酸素を使用してエチルベンゼンを酸化する方法です。この反応では、メチルフェニルケトンと酢酸が副生成物として生成されます。
メチルフェニルケトンは、水素化ホウ素ナトリウムや水素化アルミニウムリチウムなどの還元剤を用いてフェニルアセトンを還元することにより合成できます。この反応により、メチルフェニルケトンと対応するアルコールが副生成物として生成されます。
別の方法では、塩化アルミニウム触媒の存在下で塩化ベンゾイルとエチルベンゼンを反応させ、副生成物としてメチルフェニルケトンと塩化水素を生成します。
メチルフェニルケトンの用途
メチルフェニルケトンは、さまざまな産業でいくつかの用途があります。
- メチルフェニルケトンは、さまざまな樹脂、セルロースエステル、プラスチックの溶剤として広く使用されています。
- 食品業界では、特にチェリー風味やアーモンド風味の香料としてメチルフェニルケトンが使用されています。
- 香水産業では、香水やその他の香りのする製品を製造するための原料としてメチルフェニルケトンが使用されています。
- メチルフェニルケトンを用いて医薬品、農薬、染料などのさまざまな化学品が合成されます。
- メチルフェニルケトンは、アンフェタミン合成の前駆体であるフェニルアセトンの製造における中間体として機能します。
- 石鹸や洗剤に使用される香料であるクマリンは、メチルフェニルケトンから合成されます。
- 有機化学試薬では、さまざまな化合物を合成するための試薬としてメチルフェニルケトンが使用されます。
- メチルフェニルケトンは、スチレンやメチルスチレンなどの他の化学物質を製造するための原料として機能します。
全体として、メチル フェニル ケトンは、その多用途な特性と用途により、さまざまな業界で幅広い用途があります。
質問:
Q: アセトフェノンは極性がありますか?
A: はい、アセトフェノンはカルボニル基 (C=O) とフェニル環の存在により極性があり、双極子モーメントが生じます。
Q: ベンズアルデヒドとアセトフェノンのどちらが極性が高いですか?
A: ベンズアルデヒドは、フェニル環に加えてアルデヒド基 (CHO) が存在するため、より高い双極子モーメントを持つため、アセトフェノンよりも極性が高くなります。
Q: アセトフェノンの IR スペクトルは?
A: アセトフェノンの IR スペクトルは、1700 cm^-1 付近に強くて広い吸収帯を示します。これは、カルボニル (C=O) の伸縮振動の特徴です。また、芳香族 CH の伸縮振動に相当する 3000 ~ 3100 cm^-1 付近のピークも見られます。
Q: アセトフェノンから安息香酸へ?
A: アセトフェノンは、過マンガン酸カリウムやクロム酸などの酸化剤を使用して酸化すると安息香酸に変換できます。この反応により、カルボニル基に隣接する炭素-炭素結合が切断され、その後、得られた中間体が酸化されて安息香酸が生成されます。
Q: ベンゼンからアセトフェノンへ?
A: ベンゼンは、塩化アルミニウムなどのルイス酸触媒の存在下、塩化アセチルまたは無水酢酸を使用するフリーデルクラフツアシル化によってアセトフェノンに変換できます。この反応により、ベンゼンの水素原子がアセチル基 (-COCH3) に置換され、その後転位してアセトフェノンが形成されます。
