アセトアミドは白色の結晶性固体で、わずかに臭気があります。酢酸とアンモニアを反応させることによって合成されます。プラスチックや医薬品の製造によく使用されます。
| IUPAC名 | エタンアミド |
| 分子式 | C2H5NO |
| CAS番号 | 60-35-5 |
| 同義語 | 酢酸アミド、エタミド、エタンアミド、CH3CONH2 |
| インチチ | InChI=1S/C2H5NO/c1-2(3)4/h1H3,(H2,3,4) |
アセトアミドの性質
アセトアミドのモル質量
アセトアミドのモル質量は 59.07 g/mol で、これはアセトアミド分子内のすべての原子の原子質量の合計です。化合物のモル質量は、特定のサンプル中に存在する化合物のモル数を決定するのに役立ちます。化合物の質量パーセント組成を計算するためにも使用されます。
アセトアミドの沸点
エタンアミドの沸点は222℃です。これは、エタンアミドが液体から気体に変化する温度です。物質の沸点は分子間力の強さに影響され、エタンアミドは分子間に強い水素結合を持っています。したがって、他のアミドに比べて沸点が比較的高くなります。
アセトアミドの融点
エタンアミドの融点は82.5℃です。これは、エタンアミドが固体から液体に変化する温度です。物質の融点は分子間力の強さに影響され、エタンアミドの場合は分子間に強い水素結合が存在します。したがって、他のアミドに比べて融点が比較的高くなります。
アセトアミド密度 g/ml
エタンアミドの密度は 1.16 g/mL です。密度は単位体積あたりの物質の質量であり、物質の識別と特性評価に役立つ物理的特性です。アセトアミドは比較的密度の高い化合物であり、その密度はさまざまな用途の計算に使用できます。
アセトアミドの分子量
アセトアミドの分子量は 59.07 g/mol です。この値は、サンプル中に存在するアセトアミドの量を決定する場合や、化学反応における化学量論的な計算に役立ちます。
アセトアミドの構造
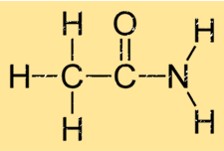
アセトアミドは、アミノ基(NH2)にカルボニル基(C=O)が結合した単純な構造をしています。これにより、分子式 C2H5NO が得られます。カルボニル基とアミノ基は単一の炭素原子で結合されています。エタンアミドの構造により、他のエタンアミド分子と強い水素結合を形成することができ、これが沸点や融点などの物理的特性に寄与します。
アセトアミドの配合
エタンアミドの化学式は CH3CONH2 で、炭素原子 1 つ、水素原子 2 つ、窒素原子 1 つ、酸素原子 1 つが含まれていることを示します。この式は、化合物中に存在する元素とその比率を特定するのに役立ちます。また、エタンアミドが関与する化学反応の化学量論を決定するのにも役立ちます。
| 外観 | 白色の結晶固体 |
| 比重 | 1.16g/ml |
| 色 | 無色 |
| 匂い | わずかな臭い |
| モル質量 | 59.07g/モル |
| 密度 | 1.16g/ml |
| 融合点 | 82.5℃ |
| 沸点 | 222℃ |
| フラッシュドット | 適用できない |
| 水への溶解度 | 完全に混和可能 |
| 溶解性 | エタノール、エーテル、ベンゼン、クロロホルムに可溶 |
| 蒸気圧 | 0.000138 mmHg(25℃) |
| 蒸気密度 | 2.1 |
| pKa | 16.5 |
| pH | 6.5~7.5(10%水溶液) |
アセトアミドの安全性と危険性
アセトアミドは比較的安全な化合物であると考えられていますが、それでもいくつかの危険を引き起こす可能性があります。長時間暴露すると、皮膚、目、呼吸器系に炎症を引き起こす可能性があります。また、摂取すると胃腸の炎症や中枢神経系の抑制を引き起こす可能性があります。アセトアミドは可燃性であり、熱や炎にさらされると火災を引き起こす可能性があります。エタンアミドを慎重に取り扱い、作業するときは手袋や安全メガネなどの保護具を使用することが重要です。不必要な暴露を避け、潜在的なリスクを最小限に抑えるために、適切な換気と保管も必要です。
| ハザードシンボル | なし |
| セキュリティの説明 | 長時間の暴露は避けてください。保護具を着用してください。適切な換気と保管が必要です。 |
| 国連識別番号 | 適用できない |
| HSコード | 29242990 |
| 危険等級 | OSHA または GHS によって危険物として分類されていない |
| 梱包グループ | 適用できない |
| 毒性 | LD50 (経口、ラット): 3.8 g/kg; LC50 (吸入、ラット): >20 mg/L (4 時間暴露) |
アセトアミドの合成法
アンモニアまたはアンモニウム塩は酢酸と反応してエタンアミドを合成し、アンモニアは塩化アセチルと反応してエタンアミドを合成し、酢酸アンモニウムは脱水してエタンアミドを合成します。
最初の方法では、酸化亜鉛または銅が酢酸とアンモニアまたはアンモニウム塩の反応を触媒してエタンアミドを合成します。この反応により、エタンアミドと水が副生成物として生成されます。
2 番目の方法では、水酸化ナトリウムやアンモニアガスなどの塩基が塩化アセチルと反応してエタンアミドが生成されます。この反応により、エタンアミドと塩化水素ガスが副生成物として生成されます。
3 番目の方法では、硫酸などの脱水剤により酢酸アンモニウムの脱水が促進され、副生成物としてエタンアミドと水が合成されます。
アセトアミドの用途
アセトアミドは、その独特の特性により、さまざまな業界で多くの用途に使用されています。エタンアミドの一般的な用途には次のようなものがあります。
- 溶剤: メーカーはプラスチック、繊維、樹脂を製造するための溶剤としてよく使用します。
- 製薬産業: 製薬産業では、さまざまな薬物合成の原料として、また特定の抗生物質の安定剤としても使用されます。
- 繊維産業: 繊維産業では、ナイロンなどの合成繊維の柔軟剤として、また綿やその他の天然繊維の染色剤として使用されます。
- 化学産業: アクリロニトリル、無水酢酸、アクリルアミドなどのさまざまな化学物質の製造における化学中間体としても使用されます。
- 食品産業: 焼き菓子、キャンディー、アイスクリームなどの一部の食品の香料および原料として使用されます。
- 実験室研究: 溶媒、試薬として、またタンパク質の変性剤として実験室研究で使用されます。
質問:
Q: アセトアミドを酢酸エチルに変換する試薬または試薬の順序は何ですか?
A: アセトアミドは、ピリジンなどの塩基の存在下でクロロギ酸エチルと反応させることで酢酸エチルに変換できます。反応により、酢酸エチル、二酸化炭素、塩化水素ガスが副生成物として生成されます。
Q: アセトアミドはアミノ酸ですか?
A: いいえ、エタンアミドはアミノ酸ではありません。これは酢酸の誘導体であり、アミノ基 (-NH2) の代わりにアミド官能基 (-CONH2) を含んでいます。
Q: アセトアミドとHO-の反応生成物は何ですか?
A: アセトアミドと HO- (水酸化物イオン) の反応により、アセトアミドが加水分解されて酢酸とアンモニアが生成されます。
Q: 結晶からアセトアミド溶媒を除去するにはどうすればよいですか?
A: 結晶からエタンアミド溶媒を除去するには、再結晶や真空濾過などの技術を使用できます。再結晶には、水などの適切な溶媒に結晶を溶解し、その後溶媒をゆっくり蒸発させて純粋な結晶を得ることが含まれます。真空濾過では、減圧下で濾紙を通して結晶を濾過し、残留エタンアミド溶媒を除去します。
Q: アセトアミドには水素結合がありますか?
A: はい、エタンアミドは、その分子構造中に水素結合受容体 (-CO) と水素結合供与体 (-NH2) が存在するため、水素結合に参加できます。
