過酸化カリウム (K2O2) は、カリウムと酸素から作られる化合物です。さまざまな化学反応を促進するために、産業や研究室で強力な酸化剤としてよく使用されます。
| IUPAC名 | ペルオキシオキシダニドカリウム |
| 分子式 | K2O2 |
| CAS番号 | 17014-71-0 |
| 同義語 | 超酸化カリウム;二酸化二カリウム;二酸化カリウム;酸化過カリウム |
| インチチ | InChI=1S/2K.O2/c;;1-2/q2*+1;-2 |
過酸化カリウムの性質
過酸化カリウムの配合
過酸化カリウムの化学式は K2O2 です。この式は、分子内に存在する原子の数と種類を表します。式は、物質を特定し、その化学的特性を理解するために重要です。
過酸化カリウムのモル質量
K2O2 のモル質量は 110.2 g/mol です。これは、1 モルの K2O2 の重さが 110.2 グラムであることを意味します。モル質量は、特定の質量または体積中に存在する物質の量を計算できるため、物質の重要な特性です。
過酸化カリウムの沸点
K2O2 には沸点に達する前に分解するため、特定の沸点がありません。高温では、K2O2 は酸化カリウムと酸素ガスに分解します。したがって、通常は高温用途では使用されません。
過酸化カリウムの融点
K2O2の融点は655℃です。この高い融点により、高温反応における酸化剤として適しています。ただし、高温または多湿にさらされると、融点に達する前に分解する可能性があることに注意してください。
過酸化カリウムの密度 g/mL
K2O2 の密度は 2.08 g/mL です。この高密度により、水に沈む高密度の固体になります。 K2O2 の密度は、さまざまな溶媒への溶解度を決定する際にも重要です。
過酸化カリウムの分子量
K2O2 の分子量は 110.2 g/mol です。この値は、分子内に存在するすべての原子の原子量の合計です。分子量は、分子量や密度などの物質のさまざまな特性を計算するために使用される重要な特性です。
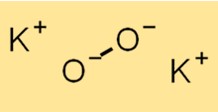
過酸化カリウムの構造
K2O2 の構造は、K+ カチオンと O2^2- アニオンで構成されます。 O2^2- アニオンは、共有結合した 2 つの酸素原子から構成されます。 K2O2 の構造は、その化学的特性と反応性を理解するために不可欠です。
| 外観 | 白色から淡黄色の固体 |
| 比重 | 2.08 |
| 色 | 白色~淡黄色 |
| 匂い | 無臭 |
| モル質量 | 110.2g/モル |
| 密度 | 2.08g/ml |
| 融合点 | 655℃ |
| 沸点 | 沸騰する前に分解してしまう |
| フラッシュドット | 適用できない |
| 水への溶解度 | 水と反応する |
| 溶解性 | 有機溶剤に不溶 |
| 蒸気圧 | 適用できない |
| 蒸気密度 | 適用できない |
| pKa | 適用できない |
| pH | 適用できない |
過酸化カリウムの安全性と危険性
K2O2 は、その強力な酸化特性により、いくつかの安全上のリスクを引き起こします。水や湿気と激しく反応し、酸素ガスを放出し、熱を発生します。この反応は、正しく処理しないと火災や爆発を引き起こす可能性があります。さらに、接触すると皮膚や目に炎症を引き起こす可能性があり、その粉塵を吸入すると呼吸器系の問題を引き起こす可能性があります。 K2O2 を慎重に取り扱い、適切な個人用保護具を着用し、熱源や混入しない物質から離れた涼しく乾燥した場所に保管することが重要です。誤って暴露した場合は、直ちに医師の診察を受けてください。
| ハザードシンボル | 酸化剤 |
| セキュリティの説明 | 水にさらさないでください。保護手袋と目/顔の保護具を着用してください。熱源や混触危険物質から離れた、涼しく乾燥した場所に保管してください。 |
| 国連識別番号 | UN1504 |
| HSコード | 2829.90.90 |
| 危険等級 | 5.1 |
| 梱包グループ | Ⅱ |
| 毒性 | 皮膚や目に炎症を引き起こす可能性があります。粉塵を吸い込むと呼吸器疾患を引き起こす可能性があります。 |
過酸化カリウムの合成法
K2O2 を合成するには、水酸化カリウムと過酸化水素の反応、水酸化カリウムと過酸化バリウムの反応、超酸化カリウムの熱分解など、いくつかの方法があります。
最初の方法では、K2O2 の白色沈殿が形成されるまで、撹拌しながら水酸化カリウムを過酸化水素溶液にゆっくりと加えます。このプロセスには、混合物を濾過し、固体を冷水で洗浄して不純物を除去することが含まれます。
2 番目の方法では、水酸化カリウムの溶液を加えながら過酸化バリウムの懸濁液を撹拌します。混合物を濾過し、濾液を蒸発乾固する。次に、得られた固体を高温に加熱して、残っている過酸化バリウムを分解し、K2O2 を形成します。
3 番目の方法では、超酸化カリウムを高温に加熱して K2O2 と酸素ガスに分解します。
過酸化カリウムの用途
K2O2 は、その酸化特性により、さまざまな産業でいくつかの用途があります。その用途には次のようなものがあります。
- 漂白剤: 繊維製品や紙製品、髪や歯の美白製品の漂白剤として使用されます。
- 酸素源: 潜水艦などの閉鎖系で酸素源として使用され、水と混合すると酸素を放出する可能性があります。
- 重合: ポリスチレンの合成など、ポリマーを製造するための特定のモノマーの重合に使用されます。
- 土壌浄化: 流出油などの有機汚染物質を除去するための土壌浄化に使用されます。
- 分析化学: 分析化学において、特定の化合物の存在を確認するための酸化剤として使用されます。
- ロケット燃料: 酸素を放出する能力があるため、ロケット燃料の酸化剤として使用されます。
- 化学合成: 過マンガン酸カリウムの合成など、さまざまな有機および無機化合物の合成に使用されます。
質問:
Q: 過酸化水素と水酸化カリウムはどちらが優れていますか?
A: 使用目的によって異なります。過酸化水素は強力な酸化剤であり、消毒剤、漂白剤、髪や歯の美白剤として一般的に使用されています。一方、水酸化カリウムは強塩基であり、石鹸や洗剤の製造、また植物油からのバイオディーゼルの製造によく使用されます。
Q: 超酸化カリウム、過酸化カリウム、酸化カリウムの化学式は何ですか?
A: 化学式は、超酸化カリウムは K2O2、過酸化カリウムは K2O2、酸化カリウムは K2O です。
Q: 過酸化水素がヨウ化カリウムおよびヨウ素酸塩と反応すると何が生成されますか?
A: 過酸化水素がヨウ化カリウムおよびヨウ素酸塩と反応すると、H2O2 + KI + KIO3 → I2 + K2O + H2O という反応に従ってヨウ素が生成されます。
Q: K2O2 の酸素原子の酸化数は何ですか?
A: K2O2 の酸素原子の酸化数は -1 です。
Q: K2O2 の K の酸化数は何ですか?
A:K2O2のKの酸化数は+1です。
