臭化亜鉛 (ZnBr2) は化合物です。亜鉛と臭素という元素で構成されています。石油掘削液や電解液などさまざまな用途に使用されています。
| IUPAC名 | 臭化亜鉛 |
| 分子式 | ZnBr2 |
| CAS番号 | 7699-45-8 |
| 同義語 | 二臭化亜鉛、臭化亜鉛(II) |
| インチチ | InChI=1S/2BrH.Zn/h2*1H;/q;;+2/p-2 |
臭化亜鉛の性質
臭化亜鉛の配合
二臭化亜鉛の式は ZnBr2 です。 1 つの亜鉛原子 (Zn) と 2 つの臭素原子 (Br) から構成されます。この化合物はこれらの元素の組み合わせによって形成されます。
臭化亜鉛モル質量
二臭化亜鉛のモル質量は約 225.19 g/mol です。この値は、化合物中の 1 つの亜鉛原子と 2 つの臭素原子の原子量を加算することによって計算されます。
臭化亜鉛の沸点
二臭化亜鉛の沸点は約 464°C (867°F) です。この温度では、化合物は液体状態から気体状態に変化します。この高い沸点により、特定の産業用途に適しています。
臭化亜鉛の融点
二臭化亜鉛の融点は約 394°C (741°F) です。これは、固体化合物が液体状態に変化する温度です。融点が比較的高いのは、亜鉛原子と臭素原子間の強い相互作用によるものです。
臭化亜鉛の密度 g/mL
二臭化亜鉛の密度は約 4.20 g/mL です。この値は単位体積あたりの化合物の質量を示します。密度が高いということは、二臭化亜鉛がその体積に対して比較的重いことを示唆しています。
臭化亜鉛の分子量
二臭化亜鉛の分子量は約 225.19 g/mol です。この値は、化合物の単一分子内のすべての原子の原子量の合計を表します。
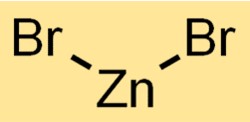
臭化亜鉛の構造
二臭化亜鉛は結晶構造を持っています。亜鉛カチオン (Zn2+) が臭素アニオン (Br-) に囲まれた繰り返しパターンのネットワークを形成します。この構造は、化合物の特性と挙動に寄与します。
臭化亜鉛の溶解度
二臭化亜鉛は水に非常に溶けます。水に加えると亜鉛カチオンと臭化物アニオンに解離し、溶液を形成します。この溶解度は、電池の電解質としての使用や石油産業用の掘削液の配合など、さまざまな用途に有利です。
| 外観 | 白色固体 |
| 比重 | 4.20g/ml |
| 色 | 無色 |
| 匂い | 無臭 |
| モル質量 | 225.19 g/モル |
| 密度 | 4.20g/ml |
| 融合点 | 394°C (741°F) |
| 沸点 | 464°C (867°F) |
| フラッシュドット | 適用できない |
| 水への溶解度 | 非常に溶けやすく、亜鉛カチオンと臭化物アニオンに解離します。 |
| 溶解性 | 水に溶ける |
| 蒸気圧 | 明確に定義されていない |
| 蒸気密度 | 適用できない |
| pKa | ~3.8 |
| pH | 酸 |
臭化亜鉛の安全性と危険性
二臭化亜鉛には安全上のリスクがいくつかあります。接触すると皮膚や目に炎症を引き起こす可能性があります。その粉塵や蒸気を吸入すると、呼吸器系の不快感を引き起こす可能性があります。手袋やメガネなどの保護具を着用し、慎重に取り扱うことが重要です。皮膚に付着した場合は水で洗い流し、刺激が残る場合は医師にご相談ください。飲み込んだ場合は、直ちに医師の診察を受けてください。混触しない物質、強酸や強塩基から遠ざけて保管してください。裸火や熱源から離れた、換気の良い場所に保管してください。全体として、潜在的なリスクを回避するには、二臭化亜鉛を取り扱う際に適切な安全対策に従うことが重要です。
| ハザードシンボル | 腐食性、飲み込むと有害 |
| セキュリティの説明 | 皮膚や目との接触を避けてください。保護服と手袋を着用してください。目に入った場合はよく洗い流してください。粉塵/蒸気を吸入すると、呼吸器官への炎症を引き起こす可能性があります。換気の良い場所に保管してください。環境への放出を避けてください。適切に処分してください。 |
| 国連識別番号 | UN3264 |
| HSコード | 28275900 |
| 危険等級 | 8 (腐食性物質) |
| 梱包グループ | Ⅱ |
| 毒性 | 中程度の毒性 |
臭化亜鉛の合成方法
二臭化亜鉛はさまざまな方法で合成できます。一般的な方法は、酸化亜鉛 (ZnO)と臭化水素酸 (HBr)を反応させることです。この反応により、二臭化亜鉛と水が生成されます。
ZnO + 2HBr → ZnBr2 + H2O
別のアプローチは、金属亜鉛とガス状臭素 (Br2) の直接反応です。この方法により、二臭化亜鉛が得られます。
Zn + Br2 → ZnBr2
二臭化亜鉛は、炭酸亜鉛 (ZnCO3) を臭化水素酸で処理することによっても調製できます。
ZnCO3 + 2HBr → ZnBr2 + H2O + CO2
さらに、酸化亜鉛と臭化水素ガス (HBr)が反応すると、二臭化亜鉛が生成されることがあります。
ZnO + 2HBr → ZnBr2 + H2O
これらの合成方法により、電解質溶液や石油掘削液での使用など、さまざまな産業用途に不可欠な化合物である二臭化亜鉛が生成されます。
臭化亜鉛の用途
二臭化亜鉛は、その独特の特性により、さまざまな分野にわたって重要な用途に使用されています。
- 化学合成: ZnBr2 は化学反応において触媒として機能します。有機合成および医薬品製造プロセスにおける特定の反応を促進します。
- 写真: 一部の写真プロセスでは、ZnBr2 が感光材料として機能し、印画紙やフィルムの製造に貢献します。
- 石油およびガス産業: ZnBr2 は石油およびガスの掘削流体において中心的な役割を果たし、圧力を維持し、坑井の噴出を防止し、掘削を安定させます。
- バッテリー電解質: 亜鉛臭素フローバッテリーなどの一部のタイプのバッテリーは、電解質として ZnBr2 を使用し、エネルギー貯蔵およびバックアップ電源システムとして機能します。
- 医療イノベーション: 研究者らは、創傷治癒や感染制御への応用を考慮し、その抗菌特性による ZnBr2 の医薬品や医薬品における可能性を模索しています。
- 繊維の強化: ZnBr2 は、特定の染料を繊維に付着させることにより、繊維の染色や印刷に使用され、それによって色堅牢度が向上します。
- 難燃剤配合: ZnBr2 はプラスチックや繊維用の難燃剤配合剤の添加剤となり、これらの材料の可燃性を効果的に低減します。
- 金属表面処理: ZnBr2 は金属表面処理に関与し、その後のコーティングや処理に向けて表面を準備する洗浄およびエッチング プロセスで使用されます。
ZnBr2 はその多用途性により、さまざまな分野で貴重な物質として利用され、技術の進歩や産業プロセスに貢献しています。
質問:
Q: 臭化亜鉛は溶けますか?
A: はい、二臭化亜鉛は水によく溶けます。
Q: 臭化亜鉛はイオン性ですか、それとも共有結合性ですか?
A: 二臭化亜鉛はイオン性化合物です。
Q: 臭化亜鉛はどのようなものですか?
A: 二臭化亜鉛は白色の結晶固体として現れます。
Q: 臭化亜鉛の式は何ですか?
A: 二臭化亜鉛の式は ZnBr2 です。
Q: ZnBr2 は水に溶けますか?
A: はい、ZnBr2 は水に溶けます。
Q:ZnBr2とは何ですか?
A: ZnBr2 は二臭化亜鉛という化合物です。
Q: ZnBr2 はイオン性ですか?それとも分子性ですか?
A: ZnBr2 は本質的にイオン性です。
Q: 1.00 g の亜鉛からどのくらいの質量の ZnBr2 を調製できますか?
A: 1.00 g の亜鉛から 1.76 g の ZnBr2 を調製できます。
Q: ZnBr2 は水に完全に溶解しますか?
A: はい、ZnBr2 は水に完全に溶解します。
Q: ZnBr2 水溶液の電気分解中に陰極でどのような生成物が形成されますか?
A: 陰極では、ZnBr2 の電気分解中に金属亜鉛が形成されます。
Q: ZnBr2 を水に溶かすと何が残りますか?
A: ZnBr2 を水に溶解すると、溶液中に Zn2+ イオンと臭化物イオン (Br-) が残ります。
