硫酸銅は、式 CuSO4 を持つ青色の結晶固体です。農業、殺菌剤、染料や顔料の製造に一般的に使用されています。
| IUPAC名 | 硫酸銅(II) |
| 分子式 | CuSO4 |
| CAS番号 | 7758-98-7 |
| 同義語 | 青色ビトリオール、硫酸銅、硫酸銅、硫酸銅(2+)塩、硫酸銅(II)、ビトリオール銅、ブルーストーン |
| インチチ | InChI=1S/Cu・H2O4S/c;1-5(2,3)4/h;(H2,1,2,3,4)/q+2;/p-2 |
硫酸銅のモル質量
硫酸銅のモル質量は、無水形 (CuSO4) で 159,609 g/mol、五水和物形 (CuSO4 ・5H2O) で 249,685 g/mol です。モル質量は、分子内のすべての原子の原子質量の合計です。硫酸銅のモル質量は、無水形態の銅 (Cu) 原子 1 個、硫黄 (S) 原子 1 個、および酸素 (O) 原子 4 個の原子量を加算するか、無水形態のモル質量に次の式を加算することによって計算されます。五水和物型の 5 つの水分子 (H2O) のモル質量。
硫酸銅の沸点
硫酸銅は沸点に達する前に分解するため、特定の沸点がありません。ただし、硫酸銅の五水和物は加熱すると水分子を失い、無水硫酸銅となり、約 650℃で分解します。硫酸銅の分解は吸熱プロセスであり、熱を吸収します。
硫酸銅の融点
硫酸銅の融点は、五水和物の場合は 110℃、無水の場合は 650℃です。融点とは、固体物質が液体状態に変化する温度です。硫酸銅の五水和物は、銅、硫黄、酸素原子間のイオン結合を破壊する可能性がある水分子の存在により、無水物よりも低い温度で溶けます。
硫酸銅の密度 g/ml
硫酸銅の密度は、無水物では 3.6 g/mL、五水和物では 2.284 g/mL です。密度は単位体積あたりの質量の尺度です。硫酸銅の密度は、五水和物の方が無水物よりも単位体積あたりに多くの水分子を含むため、その構造内の水分子の数に影響されます。
硫酸銅の分子量
硫酸銅の分子量は、無水型では 159,609 g/mol、五水和型では 249,685 g/mol です。分子量は、分子内のすべての原子の原子量の合計です。硫酸銅の分子量は、必要な硫酸銅の量または生成される硫酸銅の量を決定するために、化学反応および化学量論計算に使用されます。
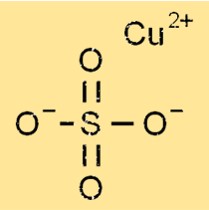
硫酸銅の構造
硫酸銅は無水物でも五水和物でも八面体構造をしており、1 つの銅原子が 4 つの酸素原子と 2 つの硫黄原子に囲まれています。五水和物の形態では、5 つの水分子が八面体構造に結合し、水和結晶格子を形成します。銅、硫黄、酸素、水の分子間のイオン結合により、硫酸銅の結晶構造が形成されます。
硫酸銅の式
硫酸第二銅の化学式は CuSO4 で、銅 (Cu) 原子 1 個、硫黄 (S) 原子 1 個、酸素 (O) 原子 4 個で構成されていることを示します。一般に硫酸銅(II)またはブルービトリオールとしても知られています。この式は、分子内に存在する各元素の原子の数を示します。
| 外観 | 青色の結晶固体 |
| 比重 | 3.6 (無水); |
| 色 | 青 |
| 匂い | 無臭 |
| モル質量 | 159,609 g/mol (無水); |
| 密度 | 3.6 g/mL (無水); |
| 融合点 | 110℃(五水和物); |
| 沸点 | 沸騰する前に分解してしまう |
| フラッシュドット | 適用できない |
| 水への溶解度 | 31.6g/100ml(20℃) |
| 溶解性 | メタノール、グリセロールに可溶、エタノールに難溶、エーテルに不溶 |
| 蒸気圧 | 適用できない |
| 蒸気密度 | 適用できない |
| pKa | 1.99 |
| pH | 3.5 – 4.5 |
硫酸銅の安全性と危険性
硫酸銅は、適切に取り扱わないと健康リスクを引き起こす可能性があります。飲み込むと有害であり、皮膚や目に接触すると炎症や火傷を引き起こす可能性があります。その粉塵や蒸気を吸入すると、呼吸器への刺激や損傷を引き起こす可能性があります。また、環境に対する潜在的な危険性があり、水生生物に有毒である可能性があります。硫酸銅を扱うときは、保護服、手袋、ゴーグルを着用するなどの予防措置を講じる必要があります。飲み込んだ場合は、毒物管理センターに連絡するか、直ちに医師の診察を受けてください。皮膚や目に入った場合は、水で数分間洗い流し、医師にご相談ください。
| ハザードシンボル | シー(イライラする) |
| セキュリティの説明 | 皮膚や目との接触を避けてください。保護手袋と目/顔の保護具を着用してください。飲み込んだ場合は医師にご相談ください。 |
| AN識別子 | UN3077 (無水用); UN1512(五水和物用) |
| HSコード | 2833.25.00 |
| 危険等級 | 9(その他の危険物) |
| 梱包グループ | Ⅲ |
| 毒性 | 飲み込むと有害な可能性があり、皮膚や目に炎症を起こし、気道に炎症を引き起こす可能性があります。 |
硫酸銅の合成法
硫酸銅を合成するには、銅と硫酸、酸化銅または水酸化銅と硫酸を反応させるなど、さまざまな方法を使用できます。
第一の方法で硫酸銅を合成するには、硫酸の入った反応容器に銅を加え、加熱して反応を開始します。銅は硫酸と反応し、硫酸銅と水が生成されます。その後、得られた混合物を冷却し、濾過して、残りの溶液から硫酸銅の結晶を分離する。
硫酸銅を合成するには、反応容器内で酸化銅または水酸化銅を硫酸と反応させます。反応後、混合物を冷却し、残った溶液から硫酸銅の結晶を濾別する。
別の方法では、反応容器内で銅を二酸化硫黄および酸素と反応させる必要があります。反応により硫酸銅と水が生成されます。得られた混合物を冷却し、濾過して硫酸銅の結晶を得る。
硫酸銅を製造するには、電気分解法を使用できます。このプロセスでは、硫酸銅の水溶液が電気分解を受け、その結果、アノード上に硫酸銅が析出します。次に、硫酸銅の結晶を溶液から分離し、乾燥させます。
硫酸銅の用途
硫酸銅の一般的な用途には次のようなものがあります。
- 植物の成長に不可欠な銅を土壌に供給する肥料として使用されます。作物の真菌性疾患を制御するための殺虫剤として使用されます。
- 動物の成長と発育に必要な銅の供給源として動物の飼料に添加されます。
業界
- 電気めっきで使用され、他の金属の表面に銅を堆積させ、耐食性を向上させます。
- 水から藻類やその他の不純物を除去するための殺藻剤および凝集剤として水処理に使用されます。
- 分析化学において、還元糖およびタンパク質を測定するための試薬として使用されます。
- 繊維業界で、染料を生地に定着させ、より鮮やかな色を与える媒染剤として使用されます。
- 栄養補助食品や医薬品の銅源として製薬業界で使用されています。
- 顔料、インク、塗料の製造、電池、触媒、木材防腐剤の製造にも使用されます。
質問:
Q: 硫酸銅は水に溶けますか?
A: はい、硫酸銅は水によく溶けます。室温では、水 100 ミリリットルあたり最大 203 グラムまで水に溶解します。
Q: 近くで硫酸銅を購入できる場所はどこですか?
A: 硫酸銅は、ほとんどの金物店、園芸センター、オンライン小売店で簡単に購入できます。硫酸銅は農業や家畜の飼料に一般的に使用されているため、地元の農産物店や飼料店に確認することもできます。
Q: 水 1 ガロンあたりの硫酸銅の量はどれくらいですか?
A: 水 1 ガロンあたりに必要な硫酸銅の量は、特定の用途によって異なります。たとえば、農業では、一般に推奨散布量は 1 エーカーあたり 1 ~ 10 ポンドです。水処理では、推奨用量は一般に水 1 リットルあたり 0.2 ~ 1.0 ミリグラムです。適切に使用するには、硫酸銅の製品ラベルに記載されている指示に注意深く従うことが重要です。
Q: 硫酸銅(ii)の式は何ですか?
A: 硫酸銅(II)の式はCuSO4です。
