硝酸ニッケル (Ni(NO₃)₂) は、ニッケルと硝酸イオンを含む化合物です。これは水に可溶で、触媒、電気メッキ、および他のニッケル化合物の前駆体としてよく使用されます。
| IUPAC名 | 硝酸ニッケル |
| 分子式 | Ni(NO₃)₂ |
| CAS番号 | 13138-45-9 |
| 同義語 | 硝酸ニッケル(II)、硝酸ニッケル、ジニトロニッケル、ビス(硝酸)ニッケル |
| インチチ | InChI=1S/2NO3.Ni/c2 2-1(3)4;/q2 -1;+2 |
硝酸ニッケルの性質
硝酸ニッケルの配合
二硝酸ニッケルの化学式は Ni(NO₃)₂ です。ニッケルカチオン(Ni)と硝酸アニオン(NO3)から構成される化合物を表します。式の下付き文字「2」は、各 Ni+2 カチオンに対して 2 つの NO3- イオンが存在することを示します。
硝酸ニッケルのモル質量
二硝酸ニッケルのモル質量は、構成元素の原子量を加算することで計算できます。ニッケル (Ni) のモル質量は約 58.69 g/mol ですが、硝酸塩 (NO3) のモル質量は約 62.00 g/mol です。それらを合計すると、二硝酸ニッケルのモル質量は約 182.69 g/mol になります。
硝酸ニッケルの沸点
二硝酸ニッケルの沸点は、液体から気体に変化する温度を指します。二硝酸ニッケルの沸点は約摂氏 136.7 度 (華氏 278.06 度) です。ただし、この値は化合物の純度によってわずかに異なる場合があることに注意することが重要です。
硝酸ニッケルの融点
二硝酸ニッケルの融点は、固体から液体に変化する温度です。二硝酸ニッケルの融点は約摂氏 56.7 度 (華氏 134.06 度) です。沸点と同様に、融点も化合物の純度に影響される可能性があります。
硝酸ニッケルの密度 g/mL
二硝酸ニッケルの密度は、単位体積あたりの質量の尺度です。二硝酸ニッケルの密度は約 1.68 g/mL です。この値は、密度が 1 g/mL である水よりも密度が高いことを示します。
硝酸ニッケルの分子量
二硝酸ニッケルの分子量は、その化学式に存在するすべての原子の原子量の合計です。前述したように、二硝酸ニッケルの分子量は約 182.69 g/mol です。
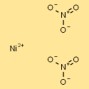
硝酸ニッケルの構造
二硝酸ニッケルの構造は、カチオンあたり 2 つの硝酸アニオン (NO3-) に囲まれたニッケル カチオン (Ni2+) として視覚化できます。硝酸イオンはニッケルカチオンと配位結合を形成し、安定したイオン化合物を生成します。
硝酸ニッケルの溶解度
二硝酸ニッケルは水に非常に溶けやすく、透明な緑がかった青色の溶液を形成します。その水溶性は、触媒、電気めっき、その他のニッケル化合物の製造など、さまざまな用途に簡単に使用できるため、不可欠な特性です。
| 外観 | 緑がかった青色の固体 |
| 比重 | 1.68g/ml |
| 色 | 緑がかった青 |
| 匂い | 無臭 |
| モル質量 | 182.69 g/モル |
| 密度 | 1.68g/ml |
| 融合点 | 56.7℃ |
| 沸点 | 136.7℃ |
| フラッシュドット | 適用できない |
| 水への溶解度 | 非常に溶けやすい |
| 溶解性 | 水およびエタノールなどの有機溶媒に可溶 |
| 蒸気圧 | 利用不可 |
| 蒸気密度 | 利用不可 |
| pKa | 利用不可 |
| pH | ニュートラル (7 程度) |
一部の特性は二硝酸ニッケルに利用できない、または関連しない場合があることに注意してください。
硝酸ニッケルの安全性と危険性
二硝酸ニッケルには安全上のリスクがいくつかあるため、取り扱いには注意が必要です。化合物に直接接触すると、皮膚や目に炎症を引き起こす可能性があります。その粉塵や煙を吸入すると、呼吸器官への炎症を引き起こす可能性があります。硝酸ニッケルを扱う場合は、手袋や安全メガネなどの適切な保護具を着用することが不可欠です。健康を損なう恐れがありますので摂取を避けてください。誤って暴露した場合は、直ちに医師の診察を受けてください。さらに、潜在的なリスクを最小限に抑え、安全な取り扱いを確保するには、不適合物質から離れた換気の良い場所で適切に保管することが重要です。
| ハザードシンボル | 腐食性、刺激性、健康被害 |
| セキュリティの説明 | 皮膚や目の炎症を引き起こします。吸入したり飲み込んだりすると有害です。取り扱い注意。直接の接触は避けてください。保護具を使用してください。 |
| 国連識別番号 | UN2724 |
| HSコード | 2834.2990 |
| 危険等級 | 5.1 (酸化性物質) |
| 梱包グループ | Ⅱ |
| 毒性 | 中程度の毒性 |
硝酸ニッケルの合成方法
二硝酸ニッケルを合成するにはいくつかの方法があります。一般的な方法には、酸化ニッケル (NiO)または水酸化ニッケル (Ni(OH)2)と硝酸 (HNO3) との反応が含まれます。このプロセス中に、酸化ニッケルまたは水酸化ニッケルが硝酸に溶解し、副生成物として二硝酸ニッケルと水が生成します。
反応は次のような表現をとることができます。
- 酸化ニッケルの場合: NiO + 2HNO₃ → Ni(NO₃)₂ + H₂O
- 水酸化ニッケルの場合: Ni(OH)₂ + 2HNO₃ → Ni(NO₃)₂ + 2H₂O
別のアプローチには、金属ニッケルと濃硝酸の反応が含まれており、その結果、副生成物として二硝酸ニッケルと二酸化窒素ガス (NO₂) が生成されます。
- ニッケル金属の場合: Ni + 4HNO₃ → Ni(NO₃)₂ + 2H₂O + 2NO₂
硝酸は強力な酸化剤であり危険な場合があるため、これらの反応を十分に制御された条件下で実行することが重要です。適切な安全対策と装置を積極的に採用することで、合成プロセス中に安全で成功した結果を確保します。さらに、試薬と反応条件の選択は、特定の用途と二硝酸ニッケル製品の望ましい特性に応じて異なります。
硝酸ニッケルの用途
二硝酸ニッケルは、その独特の特性により、さまざまな産業で複数の用途に使用されています。主な用途のいくつかを次に示します。
- 電気めっき: 二硝酸ニッケルを使用すると、さまざまな金属上にニッケルの薄層を析出させることができ、電気めっきプロセス中の耐食性と外観が向上します。
- 触媒: 化学反応における触媒として重要な役割を果たし、特に有機合成において、反応物質から目的の生成物への変換を促進します。
- セラミック: セラミック業界では、特定の色を付与し、セラミック材料の性能を向上させるために二硝酸ニッケルを使用しています。
- ガラス産業: ガラス産業のメーカーは、望ましい光学特性を持つ色ガラスを製造するために二硝酸ニッケルを使用しています。
- 電池の製造: メーカーは、ニッケル金属水素化物 (NiMH) 電池などのニッケルベースの電池の製造に硝酸ニッケルを使用しています。
- 燃料電池: 二硝酸ニッケルは、固体酸化物型燃料電池 (SOFC) の酸化ニッケル電極の製造において前駆体として機能します。
- 花火: 花火では、硝酸ニッケルが酸化剤として機能し、花火に緑色の炎を生成します。
- 化学試薬: さまざまな化学反応、特にニッケル錯体が関与する反応において試薬として機能します。
- 肥料: 農業では、特定の作物のニッケル欠乏に対処するために、硝酸ニッケルが肥料中のニッケル源として使用されることがあります。
さまざまな産業における二硝酸ニッケルの多様な用途は、さまざまな実用的な用途を持つ多用途化合物としてのその重要性を浮き彫りにしています。
質問:
Q: リン酸アンモニウムと硝酸ニッケル(ii)の溶液を混合すると、何が沈殿しますか?
A: リン酸ニッケル(II)が沈殿します。
Q: 500 ml 中に 5.8 グラムの硝酸ニッケルを含む溶液のモル濃度は何ですか?
A: モル濃度は0.2Mです。
Q: 硝酸ニッケルはどの波長を吸収しますか?
A: 二硝酸ニッケルは紫外および可視領域の波長を吸収します。
Q: 硝酸ニッケル II は可溶ですか?
A: はい、二硝酸ニッケル(II)は水溶性です。
Q: 硝酸ニッケル II の式は何ですか?
A: 式は Ni(NO₃)₂ です。
Q: 硝酸ニッケル II の色は何ですか?
A: 二硝酸ニッケル(II)の色は緑がかった青色です。
Q: 化学式 Ni(NO₃)₂ には窒素原子がいくつありますか?
A: 窒素原子は 4 つあります。
Q: Ni(NO₃)₂ は水に溶けますか?
A: はい、Ni(NO₃)₂ は水に溶けます。
Q: C4H10、BaCl2、Ni(NO3)2、SF6 のどれが式単位として存在すべきですか?
A: C4H10 (ブタン) と SF6 (六フッ化硫黄) は式単位として存在する必要があります。 BaCl2 と Ni(NO3)2 はイオン性化合物です。
