炭酸アンモニウム ((NH4)2CO3) は塩です。アンモニアと二酸化炭素が反応すると生成します。塩を焼いたり、匂いを嗅いだりするなど、さまざまな用途があります。
| IUPACの名称 | 炭酸アンモニウム |
| 分子式 | (NH4)2CO3 |
| CAS番号 | 506-87-6 |
| 同義語 | パンアンモニア、揮発性塩、ハートホルン塩、E503 |
| インチチ | InChI=1S/CH2O3・2H3N/c2-1(3)4;;/h(H2,2,3,4);2*1H3 |
炭酸アンモニウムの性質
炭酸アンモニウムの配合
炭酸アンモニウムの化学式または分子式は、(NH4)2CO3 1です。 2つのアンモニウムイオンと1つの炭酸イオンから構成される塩です。イオンの電荷を示すには、NH4+ + NH4+ + CO3 2- と書くことができます。
炭酸アンモニウムのモル質量
(NH4)2CO3 のモル質量は 96.09 g/mol 2です。モル質量を計算するには、式内のすべての原子の原子質量を合計する必要があります。原子質量は次のとおりです。
- 窒素: 14.01 g/mol
- 水素: 1.01 g/mol
- 炭素: 12.01 g/mol
- 酸素: 16.00 g/mol
したがって、炭酸アンモニウムのモル質量は次のようになります。
(2 x 14.01) + (8 x 1.01) + 12.01 + (3 x 16.00) = 96.09 g/mol
炭酸アンモニウムの沸点
(NH4)2CO3 は沸点を持ちません。この温度に達する前に分解するからです。加熱するとアンモニアと二酸化炭素に分解し、固体から放出されます。分解反応は次のようになります。
(NH4)2CO3 -> 2NH3 + CO2 + H2O
分解温度は環境の湿度や圧力によって異なりますが、一般的には60℃程度です。
炭酸アンモニウム 融点
(NH4)2CO3 の融点は 58°C (136°F; 331 K) です。ただし、この温度でも分解するため、液相は形成されません。代わりに、固体から気体に直接昇華します。
炭酸アンモニウムの密度 g/ml
(NH4)2CO3 の密度は 1.50 g/ml です。密度は物質の単位体積あたりの質量です。密度を計算するには、質量を体積で割ります。たとえば、10 g の (NH4)2CO3 があり、それが 6.67 ml の空間を占める場合、密度は次のようになります。
10g / 6.67ml = 1.50g/ml
炭酸アンモニウムの分子量
(NH4)2CO3 の分子量はそのモル質量と同じで、96.09 g/mol です。分子量とモル質量はしばしば同じ意味で使用されますが、意味は若干異なります。分子量は物質 1 分子の質量であり、モル質量は物質 1 モル (6.022 x 10^23 分子) の質量です。
炭酸アンモニウムの構造
(NH4)2CO3 の構造は、ルイスドット構造または球と棒のモデルで表すことができます。ルイス ドット構造は、各原子の価電子と、結合を形成するためにそれらがどのように共有または移動されるかを示します。ボールとスティックのモデルは、原子と結合の形状と配置を 3 次元で示します。
炭酸アンモニウムの考えられるルイスドット構造は次のとおりです。
ああああ
|| || ||
HNH HNH HCH
| | |
ふーん
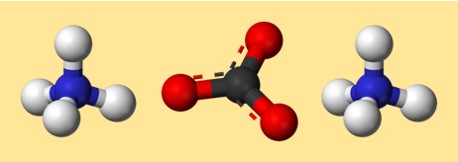
炭酸アンモニウムの考えられるモデルは次のとおりです。
このモデルでは、各色が異なる要素を表します。
- グレー:カーボン
- 赤:酸素
- 青:窒素
- 白:水素
炭酸アンモニウムの溶解度
(NH4)2CO3 は水に溶けます。溶解度は、物質が別の物質に溶解する能力です。 (NH4)2CO3 が水に溶解すると、溶液中の他のイオンや分子と相互作用できる水性イオンが形成されます。溶解反応は次のとおりです。
(NH4)2CO3 + H2O -> 2 NH4+ + CO3 2- + H2O
(NH4)2CO3 の溶解度は、水の温度と pH に依存します。温度が高くなると、より多くの (NH4)2CO3 が水に溶解します。
| 外観 | 白い粉 |
| 比重 | 1.50 |
| 色 | 無色 |
| 匂い | 刺激的なアンモニア臭 |
| モル質量 | 96.09g/モル |
| 密度 | 1.50g/ml |
| 融合点 | 58°C (136°F; 331K) |
| 沸点 | 沸騰する前に分解してしまう |
| フラッシュドット | 適用できない |
| 水への溶解度 | 100g/100ml(15℃) |
| 溶解性 | 水、アルコール、アセトンに可溶 |
| 蒸気圧 | 利用不可 |
| 蒸気密度 | 利用不可 |
| pKa | 9.25 (NH4+の場合) |
| pH | 7.8 (0.1 M 溶液の場合) |
炭酸アンモニウムの安全性と危険性
(NH4)2CO3 は、皮膚、目、鼻、喉、肺に刺激や損傷を引き起こす可能性がある有害物質です。飲み込むと有害になる可能性もあります。手袋、ゴーグル、マスクなどの個人用保護具を着用し、慎重に取り扱う必要があります。熱、火花、炎から離れた、涼しく乾燥した換気の良い場所に保管してください。激しく反応したり有毒ガスを発生する可能性があるため、強酸、塩基、還元剤と混合しないでください。暴露した場合は、直ちに医師の診察を受けてください。
| ハザードシンボル | シー(イライラする) |
| セキュリティの説明 | S22:粉塵を吸い込まないでください。 S24/25: 皮膚や目との接触を避けてください。 |
| 国連識別番号 | UN3077 |
| HSコード | 28369910 |
| 危険等級 | 9 |
| 梱包グループ | Ⅲ |
| 毒性 | 経口LD50ラット: 2000 mg/kg |
炭酸アンモニウムの合成法
(NH4)2CO3 は、出発原料と目的の生成物の純度に応じて、さまざまな方法で合成できます。 (NH4)2CO3 を合成する方法の例をいくつか示します。
- 1 つの方法では、オーブン内で硫酸アンモニウムを塩化アンモニウムおよび炭酸カルシウムと反応させることが必要です。この反応により、(NH4)2CO3 と塩化カルシウムが副生成物として生成されます。反応は次のとおりです。
(NH4)2SO4 + 2 NH4Cl + CaCO3 -> 2 (NH4)2CO3 + CaCl2
- 別の方法では、水溶液中で二酸化炭素とアンモニアを反応させます。この反応により、(NH4)2CO3 と水が副生成物として生成されます。反応は次のとおりです。
CO2 + 2 NH3 + H2O -> (NH4)2CO3 + H2O
- 3 番目の方法では、アンモニウム溶液を二酸化炭素を含む空気に曝露します。重炭酸アンモニウムは反応生成物であり、加熱するとさらに分解されて (NH4)2CO3 になります。
反応は次のとおりです。
NH3 + CO2 + H2O -> NH4HCO3
NH4HCO3 -> NH3 + CO2 + H2O
(NH4)2CO3 -> (NH4)2CO3
- 重炭酸アンモニウムを空気にさらすと、商業用に (NH4)2CO3 が生成されます。重炭酸アンモニウムはアンモニアと二酸化炭素に分解され、それらが再び反応して (NH4)2CO3 を形成します。プロセスは次のとおりです。
NH4HCO3 -> NH3 + CO2
NH3 + CO2 -> (NH4)2CO3
炭酸アンモニウムの用途
(NH4)2CO3 は、次のようなさまざまな分野でさまざまな用途に使用されます。
- パン屋は、特にフラットまたはクリスピーなビスケットやクラッカーの脱着剤として使用します。二酸化炭素とアンモニアガスが発生し、生地が膨らみ、軽い食感が生まれます。また、焼き菓子の風味と香りも向上します。
- 人々は、気を失った人や不幸を感じている人を蘇生させるための香りの塩としてそれを使用します。鼻や肺を刺激するアンモニア蒸気を放出することで呼吸器系を刺激し、血圧を上昇させます。
- Buckley’s Cough Syrup などの一部の咳止めシロップや去痰薬では、有効成分としてそれが使用されています。粘液の分泌を増加させることで、胸や喉から痰を緩め、排出するのに役立ちます。
- 医師は中毒や過剰摂取の場合に嘔吐を誘発する催吐剤として使用します。胃の内壁を刺激し、二酸化炭素を放出することで吐き気や嘔吐を引き起こします。
- 化学者は、尿素、硝酸アンモニウム、硫酸アンモニウムの合成など、いくつかの化学反応の試薬としてこれを使用します。また、溶液の pH を維持するための緩衝剤としても機能します。
質問:
Q: 炭酸アンモニウムは酸性ですか、それとも塩基性ですか?
A: (NH4)2CO3 は、酸と塩基の両方と反応できる塩です。水に溶けるとアンモニウムイオンと炭酸イオンが生成されます。アンモニウムイオンは弱酸として作用し、水にプロトンを与えることができ、炭酸イオンは弱塩基として作用し、水からプロトンを受け取ることができます。溶液の pH は、アンモニウム イオンと炭酸イオンの相対強度によって決まります。炭酸イオンがアンモニウムイオンの酸よりも強い塩基である場合、溶液は塩基性になります。アンモニウムイオンが炭酸イオンの塩基より強い酸である場合、溶液は酸性になります。アンモニウムイオンと炭酸イオンの強さが同じであれば、溶液は中性になります。
Q: 炭酸アンモニウムは塩ですか?
A: はい、(NH4)2CO3 は塩です。塩は、酸と塩基が互いに中和するときに形成される化合物です。 (NH4)2CO3 は、弱塩基であるアンモニアが弱酸である炭酸と反応すると形成されます。反応は次のとおりです。
2NH3 + H2CO3 -> (NH4)2CO3 + H2O
アンモニアと炭酸は、(NH4)2CO3 の親塩基および酸です。
Q: 炭酸アンモニウム (aq) は水溶液では臭いがしますか?
A: はい、(NH4)2CO3 (aq) は水性の状態では臭気があります。臭いは溶液からのアンモニアガスの放出によるものです。アンモニアガスは刺激臭があり、鼻や肺を刺激する可能性があります。アンモニアガスは揮発性で水への溶解度が低いため、溶液から漏れる可能性があります。放出されるアンモニアガスの量は、溶液の温度と濃度によって異なります。
Q: 炭酸アンモニウムとはどのような原子ですか?
A: (NH4)2CO3 は原子ではなく、分子です。分子とは、電子を共有することによって結合された原子のグループです。原子は、定義された化学的性質を持つ物質の最小単位です。 (NH4)2CO3 は、窒素、水素、炭素、酸素の 4 つの異なる種類の原子で構成される分子です。 (NH4)2CO3 の分子式は (NH4)2CO3 です。
Q: 炭酸アンモニウムには何モルがありますか?
A: この質問に答えるには、(NH4)2CO3 が質量または体積でどのくらいあるかを知る必要があります。モルは、物質の 6.022 x 10^23 個の粒子を表す測定単位です。物質のモル数は、その質量をそのモル質量で割るか、その体積にそのモル濃度を掛けることによって計算できます。 (NH4)2CO3 のモル質量は 96.09 g/mol です。 (NH4)2CO3 のモル濃度は、水への溶解度に依存します。
たとえば、(NH4)2CO3 が 10 g ある場合、10 g を 96.09 g/mol で割ることでモル数を求めることができます。
10 g / 96.09 g/mol = 0.104 モル
0.1 M (NH4)2CO3 溶液 100 ml がある場合、100 ml に 0.1 mol/L を掛けることでモル数を求めることができます。
100ml×0.1モル/L=0.01モル
Q: 炭酸アンモニウムの化学式は何ですか?
A: 炭酸アンモニウムの化学式は (NH4)2CO3 です。この式は、(NH4)2CO3 分子には 2 つのアンモニウム イオン (NH4+) と 1 つの炭酸イオン (CO3 2-) が含まれていることを示しています。イオンの電荷は平衡しているため、分子の全体的な電荷はゼロになります。
Q: 炭酸アンモニウム 6.995 g にはアンモニウム イオンが何モル含まれていますか?
A: この質問に答えるには、次の 2 つの手順に従う必要があります。
- まず、6.995 g をそのモル質量 (96.09 g/mol) で割ることにより、6.995 g 中に (NH4)2CO3 が何モル含まれるかを決定する必要があります。
6.995 g / 96.09 g/mol = 0.0728 モル
- 次に、(NH4)2CO3 の各モルには 2 モルのアンモニウム イオンが含まれるため、この数値を 2 倍する必要があります。
0.0728 モル x 2 = 0.1456 モル
したがって、6.995 g の (NH4)2CO3 には 0.1456 モルのアンモニウム イオンが存在します。
Q: 塩酸と炭酸アンモニウムが反応するとどのようなガスが発生しますか?
A: 塩酸が (NH4)2CO3 と反応すると、二重置換反応が起こり、塩化アンモニウムと炭酸が生成されます。その後、炭酸は水と二酸化炭素に分解されます。この反応によって生成されるガスが二酸化炭素です。この反応の全体的な方程式は次のとおりです。
(NH4)2CO3 + 2 HCl -> 2 NH4Cl + H2CO3
H2CO3 -> H2O + CO2
この反応の正味のイオン方程式は次のとおりです。
CO3 2- + 2H+ -> H2O + CO2
