水酸化亜鉛 (Zn(OH)2) は、亜鉛が水と反応すると形成される白色の粉末状の物質です。腐食防止剤や薬用軟膏など、さまざまな用途に使用されています。
| IUPAC名 | 水酸化亜鉛 |
| 分子式 | 亜鉛(OH)2 |
| CAS番号 | 20427-58-1 |
| 同義語 | 二水酸化亜鉛;水酸化亜鉛(II) |
| インチチ | InChI=1S/2H2O.Zn/h2*1H2;/q;;+2/p-2 |
水酸化亜鉛の性質
水酸化亜鉛の配合
二水酸化亜鉛の式は Zn(OH)2 です。これは、イオン結合によって 2 つの OH- イオンに結合した Zn2+ イオンで構成されます。この式は、各亜鉛イオンが 2 つの水酸化基に囲まれていることを示しています。
水酸化亜鉛のモル質量
二水酸化亜鉛 (Zn(OH)2) のモル質量は、その構成元素の原子質量を加算することによって計算されます。亜鉛 (Zn) のモル質量は約 65.38 g/mol ですが、OH- 基のモル質量は約 17.01 g/mol です。したがって、二水酸化亜鉛のモル質量は約 99.42 g/mol です。
水酸化亜鉛の沸点
二水酸化亜鉛は沸点に達する前に分解するため、明確な沸点を持ちません。加熱すると酸化亜鉛(ZnO)と水(H2O)に分解します。したがって、二水酸化亜鉛は液体の状態よりも固体の状態で使用されることが一般的です。
水酸化亜鉛の融点
二水酸化亜鉛の融点は約 125°C (257°F) です。この温度では、固体の Zn(OH)2 が液体状態に変わります。高温での分解を避けるために、加熱中は二水酸化亜鉛を慎重に取り扱うことが不可欠です。
水酸化亜鉛の密度 g/mL
二水酸化亜鉛の密度は約 3.05 g/mL です。この密度値は、単位体積あたりの二水酸化亜鉛の質量を指します。密度が高いことは、二水酸化亜鉛が比較的重い化合物であることを示しています。
水酸化亜鉛の分子量
二水酸化亜鉛の分子量は約 99.42 g/mol です。これは、Zn(OH)2 分子に存在するすべての原子の原子量の合計を表します。これには、亜鉛原子と 2 つの水酸化基が含まれます。
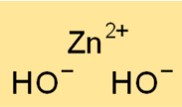
水酸化亜鉛の構造
二水酸化亜鉛は結晶構造をしており、主に白色の非晶質粉末として存在します。 Zn2+ イオンは、四面体配置で 2 つの OH- イオンに囲まれています。
水酸化亜鉛の溶解度
二水酸化亜鉛は水に溶けにくいため、限られた範囲で溶解します。水溶液中で部分的に Zn2+ イオンと OH- イオンに解離することがあります。二水酸化亜鉛の溶解度は、温度や pH などの要因に影響されます。
| 外観 | 白い粉 |
| 比重 | 適用できない |
| 色 | 白 |
| 匂い | 無臭 |
| モル質量 | 99.42 g/モル |
| 密度 | 3.05g/ml |
| 融合点 | 125°C (257°F) |
| 沸点 | 分解された |
| フラッシュドット | 適用できない |
| 水への溶解度 | 難溶性 |
| 溶解性 | 部分的に可溶性、部分的に Zn2+ イオンと OH- イオンに解離 |
| 蒸気圧 | 適用できない |
| 蒸気密度 | 適用できない |
| pKa | 適用できない |
| pH | アルカリ性(塩基性) |
水酸化亜鉛の安全性と危険性
二水酸化亜鉛には、安全上の考慮事項と危険性があります。この物質を取り扱うときは、皮膚や目との接触を避けるために、手袋やゴーグルなどの適切な個人用保護具を着用することが不可欠です。飲み込んだり吸入した場合は、直ちに医師の診察を受けてください。危険な生成物に分解されるため、高温にさらさないでください。二水酸化亜鉛は、混触物質から離れた涼しく乾燥した場所に保管してください。さらに、潜在的に有害な蒸気の蓄積を防ぐために、取り扱い中は十分な換気を確保してください。リスクを最小限に抑え、安全な使用を保証するために、常に安全ガイドラインと規制に従ってください。
| ハザードシンボル | 未分類 |
| セキュリティの説明 | PPEを着用してください。皮膚、目との接触、摂取を避けてください。暴露された場合は医師の診察を受けてください。 |
| 国連識別番号 | 適用できない |
| HSコード | 28161000 |
| 危険等級 | 未分類 |
| 梱包グループ | 未分類 |
| 毒性 | 低毒性 |
水酸化亜鉛の合成法
二水酸化亜鉛はさまざまな方法で合成できます。
一般的なアプローチには、塩化亜鉛や硫酸亜鉛などの亜鉛塩と、通常はNaOHやKOHなどの強塩基との反応が含まれます。反応はOHイオンによる塩化物イオンまたは硫酸イオンの置換によって進行し、その結果二水酸化亜鉛が形成されます。
別の方法には、アルカリ金属 OH を使用して Zn 塩溶液から二水酸化亜鉛を沈殿させる方法があります。亜鉛塩の水溶液を水酸化ナトリウムまたは水酸化カリウムの溶液に徐々に加えます。これにより、二水酸化亜鉛の白色沈殿が形成されます。
硫酸亜鉛溶液を電気分解して二水酸化亜鉛を得る。溶液に電流を流すと、亜鉛イオンが陰極に移動して水分子と反応し、電極上に二水酸化亜鉛が析出します。
全体として、これらの合成方法は、さまざまな産業、研究、医療用途向けの二水酸化亜鉛を生成できます。
水酸化亜鉛の用途
二水酸化亜鉛は、そのユニークな特性により、さまざまな分野で多くの用途に使用されています。主な用途には次のようなものがあります。
- 腐食防止剤: 二水酸化亜鉛はコーティングや塗料の腐食を抑制し、金属表面を酸化や劣化から保護し、寿命を延ばします。
- 薬用軟膏: さまざまな薬用軟膏は、防腐作用と収斂作用があるため、湿疹やおむつかぶれなどの皮膚疾患の治療に二水酸化亜鉛を使用しています。
- 医薬品有効成分 (API): 製薬業界では、胃疾患の緩和に使用される制酸薬などの医薬品には、医薬品有効成分として二水酸化亜鉛が組み込まれています。
- 水処理: 水処理プロセスでは、水から不純物や汚染物質を除去するための凝集剤として二水酸化亜鉛が使用されます。
- ゴム産業: ゴム産業では、二水酸化亜鉛が加硫プロセスの促進剤として機能し、それによってゴムの強度と弾性が向上します。
- 接着剤: 接着剤と接着剤の配合には、接着特性を強化するために二水酸化亜鉛が組み込まれています。
- 塗料乾燥剤: 二水酸化亜鉛は油性塗料の乾燥剤として機能し、乾燥プロセスをスピードアップします。
- 農業: 農業では、農家は作物をさまざまな真菌性疾患から守るために殺菌剤として二水酸化亜鉛を散布します。
- 難燃剤: メーカーはプラスチックや繊維に難燃添加剤として二水酸化亜鉛を組み込み、可燃性を低減します。
二水酸化亜鉛は多用途に利用できるため、多くの業界で貴重な化合物となり、製品の性能と安全性の向上に役立ちます。
質問:
Q: AgOH、HF、Ni(OH)2、NH4OH、HMnO4、Zn(OH)2 のどの物質が酸ですか?
A: HF (フッ化水素酸) と HMnO4 (過マンガン酸) は酸です。
Q: Zn(OH)2 の飽和溶液の pH はどれくらいですか? Ksp = 1.8 × 10^−14。
A: Zn(OH)2 の飽和溶液の pH は約 7 で、中性です。
Q: セル E° が -0.762 V の場合、Zn(OH)2 の Ksp を求めますか?
A: Zn(OH)2 の Ksp は約 4.5 × 10^−17 です。
Q: Zn(OH)2とは何ですか?
A: Zn(OH)2 は二水酸化亜鉛で、亜鉛が水と反応すると生成する白色の粉末状物質です。
Q: プラスチックの製造において重要な物質は何ですか?水酸化亜鉛、アンモニア、酢酸、硝酸?
A: 記載されている物質はいずれもプラスチックの製造に必須ではありません。
Q: 水酸化亜鉛は水溶性ですか?
A: 二水酸化亜鉛は水に溶けにくいです。
Q: 水酸化亜鉛の化学式は何ですか?
A: 二水酸化亜鉛の化学式は Zn(OH)2 です。
Q: 亜鉛が水酸化ナトリウムと反応すると何が形成されますか?
A: Zn が NaOH と反応すると、二水酸化亜鉛 (Zn(OH)2) が生成されます。
Q: 水酸化亜鉛は水に溶けますか?
A: 二水酸化亜鉛は水に溶けにくいです。
Q: 水酸化亜鉛は強塩基ですか?
A: 二水酸化亜鉛は弱塩基です。
