塩化バリウム二水和物は、化学式 BaCl2・2H2O を持つ白色の結晶性化合物です。研究室では試薬として、また産業では金属表面の処理に一般的に使用されています。
| IUPAC名 | 塩化バリウム二水和物 |
| 分子式 | BaCl2・2H2O |
| CAS番号 | 10326-27-9 |
| 同義語 | 二塩化バリウム二水和物;塩化バリウム(II)二水和物;水和塩化バリウム (1:2:2);塩化バリウム二水和物;塩化バリウム二水和物;二塩化バリウム二水和物;塩化バリウム(2+)二水和物 |
| インチチ | InChI=1S/Ba.2ClH.2H2O/h;21H;21H2/q+2;;;/p-2 |
BaCl2・2H2O モル質量
塩化バリウム二水和物 (BaCl2・2H2O) のモル質量は 244.26 g/mol です。この値は、化合物に存在する各元素の原子量を加算することで計算できます。バリウムのモル質量は 137.33 g/mol、塩素のモル質量は 35.45 g/mol、水素と酸素のモル質量はそれぞれ 1.01 g/mol と 16.00 g/mol です。 2 つの水分子により、さらに 36.02 g/mol が追加されます。 BaCl2・2H2O のモル質量は、反応物または生成物の量がモルで表される化学量論的計算において重要です。
塩化バリウム二水和物の処方
塩化バリウム二水和物の化学式はBaCl2・2H2Oです。この式は、化合物の各式単位にバリウム イオンが 1 つ、塩化物イオンが 2 つ、水分子が 2 つ含まれていることを示しています。この式は、化学量論的な計算や、化合物の化学的および物理的特性を理解するために重要です。
塩化バリウム二水和物の沸点
BaCl2・2H2Oの沸点は1560℃です。この温度では、化合物は液体から気体に相転移します。沸点が高いのは化合物のイオン性によるもので、イオンを結合する強い静電力を破壊するには大量のエネルギーが必要です。 BaCl2 2H2O は、融点と沸点が高いため、金属表面の熱処理剤として産業で使用されています。
塩化バリウム二水和物の融点
BaCl2・2H2Oの融点は962℃です。この温度では、化合物は固体から液体に変化します。 BaCl2・2H2O の融点が高いのは、バリウムと塩素イオン間の強いイオン結合、および水分子間の水素結合によるものです。 BaCl2・2H2O の融点は、顔料や染料の製造、金属表面の処理など、さまざまな用途に使用するために重要な特性です。
塩化バリウム二水和物の密度 g/ml
塩化バリウム二水和物の密度は 3.097 g/cm3 です。これは、塩化バリウム二水和物 1 cm3 の重さが 3.097 グラムであることを意味します。物質の密度は、その物理的および化学的特性についての洞察を提供できる重要な特性です。塩化バリウム二水和物の場合、密度が高いのは、バリウムの原子量が比較的大きいことと、結晶格子構造内のイオンの密充填によるものです。
BaCl2・2H2O分子量
BaCl2・2H2O の分子量は 244.26 g/mol です。この値は、化合物に存在する各元素の原子量を加算することで計算できます。 BaCl2・2H2Oは顔料や染料の製造、実験用試薬などさまざまな用途に使用されているため、分子量は重要な特性です。
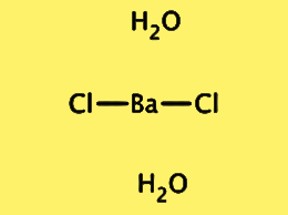
構造式 BaCl2・2H2O
BaCl2・2H2O の結晶構造は斜方晶系で、空間群は Pnma です。単位セルには、バリウム イオン 1 つ、塩化物イオン 2 つ、および水分子 2 つで構成される、式 BaCl2・2H2O の単位が 1 つ含まれています。バリウムイオンは 8 つの塩化物イオンに囲まれており、水分子は塩化物イオンに水素結合しています。 BaCl2・2H2O の結晶構造は、その物理的および化学的特性を理解するだけでなく、さまざまな用途での使用にも重要です。
| 外観 | 白色の結晶固体 |
| 比重 | 3.097 g/cm3 |
| 色 | 無色~白色 |
| 匂い | 無臭 |
| モル質量 | 244.26 g/モル |
| 密度 | 3.097 g/cm3 |
| 融合点 | 962℃ |
| 沸点 | 1560℃ |
| フラッシュドット | 適用できない |
| 水への溶解度 | 31.2g/100mL(20℃) |
| 溶解性 | アルコール、アセトンに可溶 |
| 蒸気圧 | 適用できない |
| 蒸気密度 | 適用できない |
| pKa | 適用できない |
| pH | ニュートラル (7) |
注: 使用しているプラットフォームまたはデバイスの表示設定によっては、表が正しく配置されない場合があります。
塩化バリウム二水和物の安全性と危険性
BaCl2 2H2O はいくつかの安全性と健康上の危険を引き起こし、適切に取り扱わないと有害になる可能性があります。これは腐食性の物質であり、接触すると皮膚や目に重度の火傷を引き起こす可能性があります。その粉塵や蒸気を吸入すると、呼吸器疾患や肺損傷を引き起こす可能性があります。また、摂取すると有毒であり、胃腸障害を引き起こす可能性があります。 BaCl2 2H2O は慎重に取り扱う必要があり、この化合物を扱うときは手袋、ゴーグル、マスクなどの適切な保護具を着用する必要があります。偶発的な暴露を防ぐために、不適合物質から離れた安全な場所に保管する必要があります。緊急の場合は直ちに医師の診察を受けてください。
| ハザードシンボル | 腐食性(C) | |
| セキュリティの説明 | ||
| AN識別子 | UN1564 | |
| HSコード | 28273990 | |
| 危険等級 | 8 | |
| 梱包グループ | Ⅲ | |
| 毒性 | 飲み込むと有毒です。胃腸の問題を引き起こす可能性があります。皮膚や目に腐食性がある。粉塵や蒸気を吸入すると、呼吸器疾患や肺損傷を引き起こす可能性があります。 | |
塩化バリウム二水和物の合成方法
BaCl2 2H2O はいくつかの方法で合成できます。
一般的な方法は、炭酸バリウムまたは水酸化バリウムと塩酸を反応させることです。固体化合物を得るには、得られた溶液を蒸発させる必要があります。
別の方法は、硫化バリウムと塩酸を反応させることです。この反応により硫化水素ガスが発生するため、適切に処分する必要があります。次いで、得られた溶液を濾過および結晶化によって精製して、最終生成物を得る。
塩化ナトリウムと硝酸バリウムを使用した沈殿反応によって BaCl2 2H2O を合成することもできます。 2 つの化合物を溶液中で混合し、得られた沈殿を濾過し、乾燥させて固体化合物を得る必要があります。
また、酸化バリウムと塩酸の反応によりBaCl2・2H2Oが合成できます。この反応では副生成物として水が生成されるため、蒸発によって除去する必要があります。次いで、得られた溶液を結晶化して最終生成物を得る。
BaCl2 2H2O は腐食性で有毒な化合物であるため、作業する場合は適切な安全対策を講じる必要があります。手袋、ゴーグル、マスクなどの保護具を着用し、換気の良い場所で化合物を取り扱う必要があります。
塩化バリウム二水和物の用途
BaCl2 2H2O は、さまざまな産業でいくつかの用途があります。
- 化学産業では、バリウム塩、顔料、セラミックの製造など、さまざまな化学反応の試薬として BaCl2 ・ 2H2O が使用されています。
- 金属精製におけるフラックスとして、また有機合成における触媒として機能します。
- 医療業界では、BaCl2・2H2O を X 線撮影の造影剤として、またバリウム中毒の治療に使用しています。歯科用セメントの製造にも使用されます。
- 繊維産業では、BaCl2・2H2O を媒染剤 (染料を繊維に結合させる物質) として、また繊維の難燃剤として使用しています。
- 石油産業では、BaCl2・2H2O が掘削泥水の添加剤として使用され、泥水の密度を高め、掘削作業中の噴出を防ぎます。
- 食品業界では、特定の食品の防腐剤および風味増強剤として BaCl2 2H2O を使用しています。
腐食性で有毒な BaCl2 2H2O の取り扱いに伴うリスクを最小限に抑えるために、保護具の着用や換気の良い場所での化合物の取り扱いなど、適切な安全予防措置を講じる必要があります。
質問:
塩化バリウム二水和物の化学式は何ですか?
塩化バリウム二水和物の化学式はBaCl2・2H2Oです。
塩化バリウム二水和物は水に溶けますか?
はい、塩化バリウム二水和物は水によく溶けます。水に容易に溶解し、室温での溶解度は約 31.2 g/100 mL です。この高い溶解性により、バリウム塩の製造や石油産業の掘削泥水添加剤など、さまざまな産業で有用な化合物となっています。しかし、溶解度が高いということは、正しく取り扱わないと水源を汚染し、水生生物に毒性を引き起こす可能性があるため、人間の健康や環境に危険をもたらす可能性があることも意味します。したがって、BaCl2 2H2O を扱うときは、汚染を避けて安全な取り扱いを確保するために、適切な予防措置を講じる必要があります。
