Il trifluoruro di azoto o NF3 è un potente gas a effetto serra utilizzato nell’industria elettronica per l’incisione e la pulizia al plasma. Ha una lunga durata atmosferica e contribuisce al cambiamento climatico.
| Nome IUPAC | Trifluoruro di azoto |
| Formula molecolare | NF3 |
| numero CAS | 7783-54-2 |
| Sinonimi | Trifluoramina, fluoruro di azoto (NF3), fluoruro di azoto (1:3), fluoruro di azoto (NF3), fluoruro di azoto (III), fluoruro di azoto, compressa, UN 2451 |
| InChI | InChI=1S/F3N/c1-4(2)3 |
Massa molare del trifluoruro di azoto
La massa molare di NF3 è 71,0 g/mol. Ciò significa che una mole di NF3 contiene 6.022 x 10^23 molecole.
Punto di ebollizione del trifluoruro di azoto
NF3 ha un punto di ebollizione di -129,04°C o -200,27°F. Questo è relativamente basso rispetto ad altri gas, rendendolo più facile da gestire nelle applicazioni industriali.
Trifluoruro di azoto Punto di fusione
Il trifluoruro di azoto ha un punto di fusione di -206,73°C o -340,11°F. Ciò significa che a temperatura ambiente NF3 è allo stato gassoso.
NF3 Densità g/ml
La densità di NF3 è 1,88 g/mL a temperatura e pressione standard. Ciò significa che il trifluoruro di azoto è più denso dell’aria e affonderà al suolo se rilasciato nell’atmosfera.
Peso molecolare del trifluoruro di azoto
Il peso molecolare di NF3 è 71,0 g/mol. È la somma dei pesi atomici di azoto e fluoro nel composto.
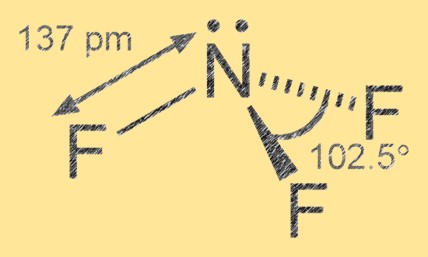
Struttura del trifluoruro di azoto
Il trifluoruro di azoto ha una geometria molecolare piramidale trigonale con l’azoto come atomo centrale e tre atomi di fluoro che lo circondano. Il legame azoto-fluoro è covalente polare, con gli atomi di fluoro che sono più elettronegativi dell’azoto, portando ad una carica negativa parziale sugli atomi di fluoro e una carica positiva parziale sull’atomo di azoto.
Formula del trifluoruro di azoto
La formula chimica del trifluoruro di azoto è NF3, che indica che una molecola di NF3 contiene un atomo di azoto e tre atomi di fluoro.
| Aspetto | Gas incolore |
| Peso specifico | 2.62 |
| Colore | Incolore |
| Odore | Inodore |
| Massa molare | 71,0 g/mole |
| Densità | 1,88 g/ml all’STP |
| Punto di fusione | -206,73°C o -340,11°F |
| Punto di ebollizione | -129,04°C o -200,27°F |
| Punto flash | Non applicabile |
| solubilità in acqua | 0,41 g/100 ml a 25°C |
| Solubilità | Solubile in solventi organici |
| Pressione del vapore | 315 kPa a 20°C |
| Densità del vapore | 2.01 (aria = 1) |
| pKa | Non applicabile |
| pH | Non applicabile |
Sicurezza e pericoli del trifluoruro di azoto
Il trifluoruro di azoto (NF3) è generalmente considerato sicuro se maneggiato correttamente, ma può comportare numerosi pericoli se maneggiato in modo errato. Può causare irritazione alla pelle e agli occhi e l’inalazione di alte concentrazioni può causare difficoltà respiratorie. Il gas NF3 può sostituire l’ossigeno in aree scarsamente ventilate, provocando asfissia. È anche un potente gas serra che contribuisce al cambiamento climatico. In caso di incendio, NF3 può rilasciare gas tossico di acido fluoridrico. È essenziale seguire protocolli di sicurezza adeguati, inclusa un’adeguata ventilazione e l’uso di dispositivi di protezione, quando si maneggia NF3 per evitare questi pericoli.
| Simboli di pericolo | T,C |
| Descrizione della sicurezza | Evitare l’inalazione e il contatto con la pelle e gli occhi. Utilizzare solo in aree ben ventilate. |
| Numeri di identificazione delle Nazioni Unite | UN2451 |
| Codice SA | 28129090 |
| Classe di pericolo | 2.3 |
| Gruppo di imballaggio | II |
| Tossicità | Molto tossico |
Metodi per la sintesi del trifluoruro di azoto
Esistono diversi metodi per sintetizzare il trifluoruro di azoto (NF3):
Un metodo comune prevede la reazione dell’ammoniaca anidra (NH3) con il fluoro gassoso (F2) in presenza di un catalizzatore come ferro, nichel o platino. La reazione produce NF3 e acido fluoridrico (HF). Le industrie utilizzano comunemente questo metodo per la produzione di NF3.
Un altro metodo prevede la decomposizione termica del fluoruro di ammonio (NH4F) ad alte temperature. La reazione produce NF3 e gas di ammoniaca (NH3). La reazione di NH3 con F2 è più efficiente di questo metodo, quindi è meno comunemente utilizzata.
Un altro metodo prevede la reazione dell’ossido nitrico (NO) con il fluoro gassoso in presenza di un catalizzatore. La reazione produce gas NF3 e biossido di azoto (NO2).
NF3 può anche essere sintetizzato elettrochimicamente facendo passare una scarica elettrica attraverso una miscela di gas N2 e F2. Il plasma risultante forma NF3 e altri composti di azoto-fluoro.
Indipendentemente dal metodo utilizzato, è fondamentale maneggiare i reagenti altamente reattivi e potenzialmente pericolosi con adeguate precauzioni di sicurezza. Tuttavia, i ricercatori devono controllare attentamente il processo di sintesi per garantire un’elevata resa e purezza del prodotto finale.
Usi del trifluoruro di azoto
Il trifluoruro di azoto (NF3) ha varie applicazioni industriali grazie alle sue proprietà uniche.
- L’industria dei semiconduttori utilizza NF3 come detergente per wafer di silicio. NF3 viene utilizzato anche nella produzione di display a schermo piatto, celle solari e sistemi microelettromeccanici (MEMS).
- La produzione di componenti elettronici utilizza NF3 come gas di incisione al plasma. Presenta un’elevata reattività e rimuove selettivamente alcuni materiali lasciandone altri intatti.
- I sistemi di raffreddamento utilizzano anche NF3 come refrigerante a causa del suo potenziale di riscaldamento globale inferiore rispetto ad altri refrigeranti, rendendolo un’opzione più rispettosa dell’ambiente.
- L’industria aerospaziale utilizza NF3 come propellente grazie al suo elevato impulso specifico, che consente un’efficiente propulsione dei veicoli spaziali.
Nonostante i suoi numerosi usi, ci sono preoccupazioni sull’impatto ambientale della NF3. È un potente gas serra con una lunga permanenza nell’atmosfera. La produzione e l’uso di NF3 possono contribuire al cambiamento climatico se non vengono prese le dovute precauzioni. Questo è il motivo per cui si stanno compiendo sforzi per ridurne l’uso e sviluppare alternative più sostenibili.
Domande:
D: Il trifluoruro di azoto (NF3) è polare?
R: Sì, NF3 è polare. Ha una geometria molecolare piramidale trigonale, con l’atomo di azoto al centro e tre atomi di fluoro disposti attorno ad esso. La forma asimmetrica della molecola provoca una distribuzione non uniforme della densità elettronica, risultando in una molecola polare.
D: Qual è la formula del trifluoruro di azoto?
R: La formula del trifluoruro di azoto è NF3, che indica che la molecola è costituita da un atomo di azoto e tre atomi di fluoro.
D: Da dove viene il trifluoruro di azoto?
R: NF3 può essere prodotto con vari metodi, tra cui la reazione dell’ammoniaca anidra con fluoro gassoso, la decomposizione termica del fluoruro di ammonio e la sintesi elettrochimica. È comunemente utilizzato nell’industria dei semiconduttori come detergente e nella produzione di componenti elettronici e propulsori aerospaziali.
D: Struttura di Lewis del trifluoruro di azoto?
R: La struttura di Lewis per NF3 è costituita da un atomo di azoto legato a tre atomi di fluoro tramite singoli legami covalenti. C’è anche una coppia di elettroni che non legano l’atomo di azoto, conferendo alla molecola una forma piramidale trigonale.
D: Forze intermolecolari del trifluoruro di azoto?
R: Le forze intermolecolari di NF3 includono interazioni dipolo-dipolo, che risultano dalla natura polare della molecola. Il molecolare sperimenta anche le forze di dispersione di London, che sono deboli forze intermolecolari risultanti da fluttuazioni temporanee nella densità elettronica.
D: NF3 è polare o non polare?
R: NF3 è polare a causa della sua forma asimmetrica e della distribuzione non uniforme della densità elettronica. La molecola ha un momento dipolare, che indica che ha un’estremità positiva e una negativa, rendendola una molecola polare.
