Il tricloruro di fosforo è un composto chimico composto da fosforo e tre atomi di cloro. È comunemente usato come reagente nelle reazioni chimiche e come precursore dei composti organofosforici.
| Nome IUPAC | Tricloruro di fosforo |
| Formula molecolare | PCl3 |
| numero CAS | 7719-12-2 |
| Sinonimi | Triclorofosfina, cloruro di fosforo, tricloruro di fosforo, cloruro di fosforo (III). |
| InChI | InChI=1S/Cl3P/c1-4(2)3 |
Proprietà del tricloruro di fosforo
Formula del tricloruro di fosforo
La formula del tricloruro di fosforo è PCl3. È costituito da un atomo di fosforo legato a tre atomi di cloro. Questo composto chimico è ampiamente utilizzato in varie industrie e laboratori per la sua reattività e versatilità.
Massa molare del tricloruro di fosforo
La massa molare della triclorofosfina può essere calcolata sommando le masse atomiche dei suoi elementi costitutivi. Il fosforo ha una massa atomica di circa 31,0 grammi per mole, mentre il cloro ha una massa atomica di circa 35,5 grammi per mole. Pertanto, la massa molare di PCl3 è di circa 137,3 grammi per mole.
Punto di ebollizione del tricloruro di fosforo
La triclorofosfina ha un punto di ebollizione di circa 76,1 gradi Celsius. Ciò significa che quando riscaldato cambia da liquido a gas. Il punto di ebollizione è una proprietà importante da considerare quando si maneggia e si utilizza la triclorofosfina in varie reazioni e processi chimici.
Tricloruro di fosforo Punto di fusione
Il punto di fusione della triclorofosfina è di circa -112,7 gradi Celsius. A questa temperatura subisce una transizione di fase da solido a liquido. Il punto di fusione è una caratteristica cruciale per determinare lo stato fisico della triclorofosfina in diverse condizioni.
Densità del tricloruro di fosforo g/mL
La densità della triclorofosfina è di circa 1,574 grammi per millilitro. La densità rappresenta la massa di una sostanza per unità di volume e fornisce informazioni sulla compattezza e la pesantezza del materiale. La densità della triclorofosfina viene spesso utilizzata nei calcoli e nelle formulazioni chimiche.
Peso molecolare del tricloruro di fosforo
Il peso molecolare della triclorofosfina, calcolato sommando i pesi atomici dei suoi costituenti, è di circa 137,3 grammi per mole. Il peso molecolare è un parametro prezioso per determinare la quantità di sostanza nelle reazioni chimiche e formulare misurazioni precise.
Struttura del tricloruro di fosforo
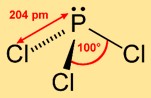
La triclorofosfina adotta una struttura piramidale trigonale, dove l’atomo di fosforo occupa l’apice e i tre atomi di cloro formano una base triangolare. Questa disposizione molecolare contribuisce alla sua reattività chimica e influenza il suo comportamento in varie reazioni.
Solubilità del tricloruro di fosforo
La triclorofosfina è scarsamente solubile in acqua, ma si dissolve facilmente in solventi organici come benzene e tetracloruro di carbonio. Le proprietà di solubilità della triclorofosfina sono considerazioni essenziali quando si determinano i solventi adatti per il suo utilizzo in diversi processi e applicazioni chimici.
| Aspetto | Liquido incolore o giallo pallido |
| Peso specifico | 1.574 g/ml |
| Colore | Incolore |
| Odore | Acri |
| Massa molare | 137,3 g/mole |
| Densità | 1.574 g/ml |
| Punto di fusione | -112,7°C |
| Punto di ebollizione | 76,1°C |
| Punto flash | Non applicabile (non infiammabile) |
| solubilità in acqua | Reagisce con l’acqua |
| Solubilità | Solubile in solventi organici come benzene e tetracloruro di carbonio |
| Pressione del vapore | 105 mmHg a 25°C |
| Densità del vapore | 4,83 (Aria = 1) |
| pKa | Non applicabile |
| pH | Acido (pH < 7) |
Sicurezza e pericoli del tricloruro di fosforo
La triclorofosfina presenta diversi rischi per la sicurezza e deve essere maneggiata con cautela. È molto corrosivo per la pelle, gli occhi e il sistema respiratorio. Il contatto diretto può causare gravi ustioni e danni agli occhi. L’inalazione dei suoi vapori può causare irritazione respiratoria e danni ai polmoni. Inoltre, la triclorofosfina reagisce violentemente con l’acqua, rilasciando vapori tossici di acido cloridrico. È infiammabile in determinate condizioni e il contatto con agenti ossidanti può provocare incendi o esplosioni. Quando si lavora con questa sostanza chimica è necessario utilizzare dispositivi di protezione individuale adeguati, come guanti, occhiali e un respiratore. Una ventilazione adeguata e uno stoccaggio lontano da sostanze incompatibili sono essenziali per ridurre al minimo i rischi.
| Simboli di pericolo | Corrosivo, tossico |
| Descrizione della sicurezza | – Provoca gravi ustioni cutanee e gravi lesioni oculari – Nocivo se ingerito, inalato o assorbito – Reagisce violentemente con l’acqua liberando fumi tossici – Infiammabile in determinate condizioni |
| Identificatori delle Nazioni Unite | ONU1809 |
| Codice SA | 2812.10.00 |
| Classe di pericolo | 8 (Corrosivo), 6.1 (Tossico) |
| Gruppo di imballaggio | II |
| Tossicità | Molto tossico |
Metodi di sintesi del tricloruro di fosforo
Vari metodi sintetizzano la triclorofosfina. Un approccio comune consiste nel riscaldare il fosforo con un eccesso di cloro gassoso, portando alla formazione di triclorofosfina.
Un altro metodo prevede il riscaldamento del pentacloruro di fosforo (PCl5) con triclorofosfina (PCl3) per produrre triclorofosfina.
La reazione tra ossido di fosforo (P2O5) e acido cloridrico (HCl) combina le due sostanze, solitamente con un condensatore a riflusso, per facilitare la sintesi della triclorofosfina.
Inoltre, il riscaldamento del tribromuro di fosforo (PBr3) con triclorofosfina determina la produzione di triclorofosfina.
È importante notare che la sintesi della triclorofosfina deve essere effettuata con adeguate precauzioni di sicurezza, poiché comporta la manipolazione di sostanze reattive e pericolose. Garantire la sicurezza durante il processo di sintesi impiegando dispositivi di protezione adeguati e mantenendo condizioni di laboratorio ben ventilate.
Nel complesso, questi diversi metodi sintetici offrono approcci diversi per ottenere la triclorofosfina, garantendo così flessibilità nella sua produzione per un’ampia gamma di applicazioni industriali e di ricerca.
Usi del tricloruro di fosforo
La triclorofosfina è ampiamente utilizzata in diverse applicazioni grazie alla sua natura versatile e reattività. Ecco alcuni usi chiave:
- Reagente chimico: serve come un importante reagente nella sintesi organica, specialmente nella produzione di composti organofosforici. Partecipa a reazioni come la reazione Vilsmeier-Haack e la reazione Pudovik.
- Catalizzatore: la triclorofosfina agisce come catalizzatore in varie reazioni chimiche, inclusa la sintesi di prodotti farmaceutici, coloranti e pesticidi.
- Fonte di fosforo: funge da fonte di fosforo nella produzione di prodotti chimici a base di fosforo come l’acido fosforoso e l’ossicloruro di fosforo.
- Ritardante di fiamma: i produttori aggiungono triclorofosfina come ritardante di fiamma ai polimeri, contribuendo a ridurre l’infiammabilità e migliorare la sicurezza antincendio dei materiali.
- Intermedio chimico: vari prodotti chimici, inclusi prodotti farmaceutici, erbicidi, insetticidi e plastificanti, vengono prodotti utilizzando la triclorofosfina come intermedio cruciale.
- Reagente di laboratorio: i laboratori utilizzano ampiamente la triclorofosfina come reagente versatile per le reazioni chimiche, inclusa la formazione di cloruri acilici e la conversione di alcoli in cloruri alchilici.
- Trattamento dell’acqua: le forti proprietà ossidanti e clorurante della triclorofosfina la rendono un componente prezioso nei processi di trattamento dell’acqua, rimuovendo efficacemente impurità e contaminanti.
- Prodotti farmaceutici: la triclorofosfina svolge un ruolo nella sintesi di composti farmaceutici, compresi i farmaci per il trattamento del cancro, dell’infiammazione e dei disturbi neurologici.
- Applicazioni agricole: trova applicazioni in agricoltura come componente di alcuni pesticidi ed erbicidi, contribuendo così alla protezione delle colture e al controllo delle infestanti.
- Produzione di plastica: i produttori utilizzano la triclorofosfina nella produzione di plastica e additivi polimerici per migliorare le proprietà dei materiali e renderli ritardanti di fiamma.
Queste varie applicazioni evidenziano l’importanza della triclorofosfina in vari settori, ricerca e applicazioni quotidiane.
Domande:
D: Il tricloruro di fosforo è una base o un acido?
R: La triclorofosfina è un acido.
D: Quanti atomi di cloro ci sono in una molecola di tricloruro di fosforo, PCl3?
R: Ci sono tre atomi di cloro in una molecola di triclorofosfina.
D: Qual è la resa percentuale di una reazione in cui reagiscono 200 g di tricloruro di fosforo?
R: La percentuale di resa non può essere determinata senza informazioni sulla quantità di prodotto ottenuto.
D: Quante moli ci sono in 15 grammi di tricloruro di fosforo?
R: In 15 grammi ci sono circa 0,116 moli di triclorofosfina.
D: Quale formula rappresenta il composto molecolare binario tricloruro di fosforo?
R: La formula PCl3 sta per triclorofosfina.
D: Qual è la formula del tricloruro di fosforo?
R: La formula del tricloruro di fosforo è PCl3.
D: Il tricloruro di fosforo è ionico o covalente?
R: La triclorofosfina è un composto covalente.
D: Quanti atomi di cloro ci sono in una molecola di tricloruro di fosforo, PCl3?
R: Ci sono tre atomi di cloro in una molecola di triclorofosfina.
D: Struttura di Lewis della triclorofosfina?
R: La struttura di Lewis della triclorofosfina ha un atomo di fosforo centrale legato a tre atomi di cloro, con coppie solitarie sull’atomo di fosforo.
D: Fosforo (P4) (s) + Cloro (g) → Triclorofosfina (l)?
R: L’equazione bilanciata rappresenta la reazione tra fosforo solido (P4) e cloro gassoso (Cl2) per formare PCl3 liquido.
D: Qual è la forma del tricloruro di fosforo?
R: La triclorofosfina ha una forma piramidale trigonale dovuta alla presenza di una coppia di elettroni liberi sull’atomo di fosforo.
D: Il tricloruro di fosforo è un composto ionico?
R: No, la triclorofosfina non è un composto ionico; è un composto covalente.
D: Il tricloruro di fosforo ha piani di riflessione?
R: No, la triclorofosfina non ha piani di riflessione.
