Il tricloruro di boro (BCl3) è un composto comprendente tre atomi di cloro legati a un atomo di boro. Viene utilizzato in vari processi industriali, come catalizzatori e come reagente nella sintesi organica.
| Nome IUPAC | Tricloruro di boro |
| Formula molecolare | BCl3 |
| numero CAS | 10294-34-5 |
| Sinonimi | Tricloroborano; Cloruro di boro (III), tricloroborano, tricloroboro |
| InChI | InChI=1S/BCl3/c2-1(3)4 |
Proprietà del tricloruro di boro
Formula del tricloruro di boro
La formula del cloruro di boro è BCl3, che rappresenta un atomo di boro legato a tre atomi di cloro. Questa è una formula molecolare semplice e diretta che descrive la composizione di questo composto.
Massa molare del tricloruro di boro
La massa molare del cloruro di boro può essere calcolata sommando le masse atomiche dei suoi elementi costitutivi. Il boro ha una massa atomica di circa 10,81 grammi per mole e ciascun atomo di cloro ha una massa atomica di circa 35,45 grammi per mole. Pertanto, la massa molare di BCl3 è di circa 117,17 grammi per mole.
Punto di ebollizione del tricloruro di boro
Il cloruro di boro ha un punto di ebollizione relativamente basso rispetto a molti altri composti. Bolle a circa -15,7 gradi Celsius o 3,77 gradi Fahrenheit. Ciò significa che a temperature superiori a questo punto, il cloruro di boro passa dalla fase liquida a quella gassosa.
Tricloruro di boro Punto di fusione
Il punto di fusione del cloruro di boro è relativamente basso. Si scioglie a circa -107,5 gradi Celsius o -161,5 gradi Fahrenheit. A temperature inferiori a questo punto, il composto passa dallo stato solido a quello liquido.
Densità del tricloruro di boro g/mL
La densità del cloruro di boro è di circa 1,38 grammi per millilitro. Questo valore indica la massa del composto per unità di volume. È utile per determinare il comportamento del cloruro di boro in varie applicazioni e comprenderne le proprietà fisiche.
Peso molecolare del tricloruro di boro
Il peso molecolare del cloruro di boro è di circa 117,17 grammi per mole. Questo valore rappresenta la somma delle masse atomiche di tutti gli atomi in una molecola del composto ed è utile per vari calcoli, come determinare la quantità di cloruro di boro in un dato campione.
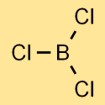
Struttura del tricloruro di boro
Il cloruro di boro ha una struttura molecolare planare trigonale. È costituito da un atomo di boro al centro legato a tre atomi di cloro, disposti a forma triangolare. Questa struttura contribuisce alle proprietà fisiche e chimiche del composto.
Solubilità del tricloruro di boro
Il cloruro di boro ha una bassa solubilità in acqua. È scarsamente solubile, ovvero si dissolve solo in misura limitata in soluzioni acquose. Tuttavia, è più solubile in solventi organici come benzene e tetracloruro di carbonio. La solubilità del cloruro di boro influenza il suo comportamento in diverse reazioni chimiche e processi industriali.
| Aspetto | Gas incolore |
| Peso specifico | 1.369 g/ml |
| Colore | Incolore |
| Odore | Acri |
| Massa molare | 117,17 g/mole |
| Densità | 1,38 g/ml |
| Punto di fusione | -107,5°C |
| Punto di ebollizione | -15,7°C |
| Punto flash | Non applicabile |
| solubilità in acqua | Reagisce |
| Solubilità | Solubile in solventi organici come benzene e tetracloruro di carbonio |
| Pressione del vapore | 623 mmHg a 20°C |
| Densità del vapore | 3,24 (aria = 1) |
| pKa | Non applicabile |
| pH | Non applicabile |
Sicurezza e pericoli del tricloruro di boro
Il cloruro di boro solleva diverse considerazioni sulla sicurezza e sui rischi. È corrosivo e può causare gravi ustioni alla pelle, agli occhi e alle vie respiratorie per contatto. L’inalazione dei suoi vapori può causare irritazione respiratoria e danni ai polmoni. Il composto è anche molto reattivo con l’acqua, rilasciando gas tossico di acido cloridrico. È essenziale maneggiare il cloruro di boro con cautela, utilizzando dispositivi di protezione individuale adeguati e garantendo un’adeguata ventilazione. In caso di esposizione accidentale è necessaria l’immediata assistenza medica. Inoltre, è necessario seguire adeguate procedure di stoccaggio e movimentazione per evitare il rischio di incendio, esplosione e rilascio di gas pericolosi.
| Simboli di pericolo | Corrosivo (C) |
| Descrizione della sicurezza | Indossare guanti protettivi/proteggere gli occhi/il viso. Non respirare la polvere/i fumi/i gas/la nebbia/i vapori/gli aerosol. Maneggiare in un’area ben ventilata. |
| Numeri di identificazione delle Nazioni Unite | UN1741 |
| Codice SA | 2827390000 |
| Classe di pericolo | 8 (Sostanze corrosive) |
| Gruppo di imballaggio | II |
| Tossicità | Molto tossico per ingestione o inalazione. Può causare gravi ustioni e irritazioni alle vie respiratorie. Maneggiare con estrema cautela. |
Metodi per la sintesi del tricloruro di boro
Un metodo per sintetizzare il cloruro di boro prevede la reazione tra ossido di boro (B2O3 ) e tetracloruro di carbonio (CCl4) in presenza di un catalizzatore come cloruro di alluminio (AlCl3) . B2O3 e CCl4 reagiscono ad alte temperature, producendo cloruro di boro e anidride carbonica come sottoprodotti.
Un altro approccio è la reazione diretta tra boro e cloro gassoso. In condizioni controllate, il boro reagisce con il cloro, dando luogo alla formazione di cloruro di boro. Questo metodo richiede un’attenta gestione del gas di cloro a causa della sua natura pericolosa.
Il cloruro di tionile (SOCl2) consente la sintesi del cloruro di boro facendo reagire il boro con SOCl2 a temperature elevate, con conseguente produzione di cloruro di boro e anidride solforosa gassosa.
Questi metodi di sintesi offrono percorsi praticabili per la produzione di cloruro di boro, sia in laboratorio che in ambienti industriali. È fondamentale garantire adeguate misure di sicurezza durante la sintesi, come lavorare in aree ben ventilate e utilizzare dispositivi di protezione adeguati. Ciò è importante a causa della natura pericolosa dei reagenti e dei prodotti coinvolti nel processo.
Scrivi gli usi del tricloruro di boro
Il cloruro di boro è ampiamente utilizzato nella catalisi, nella produzione di semiconduttori, nella sintesi dei materiali e in vari altri settori grazie alle sue proprietà chimiche uniche e alla sua versatilità.
- Il cloruro di boro (BCl3) trova applicazione come catalizzatore in varie reazioni chimiche, in particolare nella sintesi organica. Facilita la formazione di legami carbonio-carbonio e carbonio-eteroatomo nella produzione di prodotti farmaceutici, agrochimici e di chimica fine.
- BCl3 funge da reagente nella sintesi di polimeri a base di boro, come il poliborazilene, che hanno applicazioni nei rivestimenti ritardanti di fiamma e ad alta temperatura.
- BCl3 facilita la produzione di nitruro di boro, un materiale rinomato per la sua eccezionale stabilità termica e chimica, ampiamente utilizzato in applicazioni ad alta temperatura e come lubrificante.
- L’industria dei semiconduttori utilizza BCl3 come drogante per incorporare atomi di boro nei cristalli di silicio, migliorandone le proprietà elettriche e rendendoli adatti all’uso nei dispositivi elettronici.
- Nella metallurgia, BCl3 agisce come agente flussante per rimuovere le impurità degli ossidi durante la raffinazione dei metalli, migliorandone così la purezza.
- BCl3 svolge un ruolo centrale nella produzione di carburo di boro, un materiale leggero e resistente ampiamente utilizzato nella produzione di armature ceramiche e utensili da taglio.
- BCl3 svolge un ruolo cruciale nella sintesi di molti composti contenenti boro, inclusi esteri di boro, acidi boronici e borani. Questi composti hanno molte applicazioni nella ricerca chimica e nei processi industriali.
- Nell’industria petrolifera, BCl3 viene utilizzato come additivo per aumentare il numero di ottano della benzina.
Serve come fonte di boro nella produzione di vetro contenente boro, che ha proprietà ottiche e termiche desiderabili.
Domande:
D: Qual è la formula del tricloruro di boro?
R: La formula del cloruro di boro è BCl3.
D: Il tricloruro di boro è polare?
R: Sì, il cloruro di boro è una molecola polare a causa della presenza di un doppietto libero sull’atomo di boro e della disposizione asimmetrica degli atomi di cloro.
D: Cos’è l’ibridazione del boro nel tricloruro di boro (BCl3)?
R: L’ibridazione del boro in BCl3 è sp2.
D: Qual è la massa di una molecola di tricloruro di boro?
R: La massa di una molecola di cloruro di boro (BCl3) è di circa 117,17 grammi per mole.
D: Cos’è l’ibridazione del tricloruro di boro?
R: L’ibridazione del boro nel cloruro di boro (BCl3) è sp2.
D: Cosa succede quando si mescolano il tricloruro di boro e l’idrogeno?
R: Quando il cloruro di boro (BCl3) viene miscelato con l’idrogeno (H2), reagiscono per formare boro e acido cloridrico gassoso (HCl).
D: Perché il tricloruro di boro esiste come monomero mentre il tricloruro di alluminio esiste come dimero?
R: La differenza di dimensione e densità elettronica tra gli atomi di boro e di alluminio fa sì che il cloruro di boro (BCl3) esista come monomero, mentre il cloruro di alluminio (AlCl3) forma un dimero grazie alla sua capacità di formare collegamenti coordinati.
D: BCl3 è un acido di Lewis?
R: Sì, BCl3 è un acido di Lewis perché può accettare una coppia di elettroni da una base di Lewis.
D: BCl3 è ionico o covalente?
R: BCl3 è un composto covalente.
D: BCl3 è un legame covalente?
R: Sì, BCl3 è costituito da legami covalenti tra atomi di boro e cloro.
D: BCl3 è un gas?
R: Sì, BCl3 è un gas a temperatura e pressione standard (STP).
D: BCl3 è una molecola polare o non polare?
R: BCl3 è una molecola polare a causa della distribuzione non uniforme della densità elettronica causata dalla disposizione asimmetrica degli atomi di cloro attorno all’atomo di boro.
