Il tribromuro di boro (BBr3) è un composto chimico utilizzato come catalizzatore in varie reazioni. È costituito da un atomo di boro e tre atomi di bromo.
| Nome IUPAC | Tribromuro di boro |
| Formula molecolare | BBr3 |
| numero CAS | 10294-33-4 |
| Sinonimi | Tribromoborano; Bromuro di boro; Bromuro di boro(III); Bromoboro; Tribromuro di boro, [B(Br)3]; Tribromo-borano |
| InChI | InChI=1S/3BrH.B/h3*1H;/q;;;+3/p-3 |
Proprietà del tribromuro di boro
Formula del tribromuro di boro
La formula del bromuro di boro è BBr3. È costituito da un atomo di boro e tre atomi di bromo. Questo composto chimico è formato dalla combinazione di boro e bromo.
Massa molare del tribromuro di boro
La massa molare del bromuro di boro (BBr3) può essere calcolata sommando le masse atomiche del boro e di tre atomi di bromo. Il boro ha una massa atomica di circa 10,81 grammi per mole e il bromo ha una massa atomica di circa 79,90 grammi per mole. Quindi la massa molare di BBr3 è di circa 250,60 grammi per mole.
Punto di ebollizione del tribromuro di boro
Il bromuro di boro ha un punto di ebollizione relativamente basso. Inizia a bollire a circa 91 gradi Celsius (196 gradi Fahrenheit). A questa temperatura il composto subisce un cambiamento di fase da liquido a gassoso, liberando vapori di BBr3.
Tribromuro di boro Punto di fusione
Il punto di fusione del bromuro di boro è relativamente alto. Inizia a sciogliersi intorno a -46 gradi Celsius (-51 gradi Fahrenheit). A questa temperatura il composto solido si trasforma nello stato liquido.
Densità del tribromuro di boro g/mL
Il bromuro di boro ha una densità di circa 2,63 grammi per millilitro (g/mL). Questa densità indica la massa di BBr3 presente in un millilitro del composto. È una misura della compattezza o concentrazione della sostanza.
Peso molecolare del tribromuro di boro
Il peso molecolare del bromuro di boro (BBr3) viene calcolato sommando le masse atomiche del boro e di tre atomi di bromo. Il peso molecolare di BBr3 è di circa 250,60 grammi per mole.
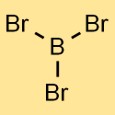
Struttura del tribromuro di boro
La struttura del bromuro di boro è costituita da un atomo di boro legato a tre atomi di bromo. La disposizione forma una geometria planare trigonale, dove l’atomo di boro è al centro e i tre atomi di bromo sono distribuiti uniformemente attorno ad esso.
Solubilità del tribromuro di boro
Il bromuro di boro è un composto molto reattivo e generalmente scarsamente solubile in acqua. Tende a reagire con l’acqua per formare acido bromidrico e acido borico. Tuttavia, BBr3 è solubile in solventi organici come cloroformio, tetracloruro di carbonio e disolfuro di carbonio.
| Aspetto | Liquido incolore |
| Peso specifico | 2,63 g/ml |
| Colore | Incolore |
| Odore | Acri |
| Massa molare | 250,60 g/mole |
| Densità | 2,63 g/ml |
| Punto di fusione | -46°C |
| Punto di ebollizione | 91°C |
| Punto flash | Non applicabile |
| solubilità in acqua | Reagisce |
| Solubilità | Solubile in solventi organici come cloroformio, CCl4 e disolfuro di carbonio |
| Pressione del vapore | 78mmHg |
| Densità del vapore | 6,52 (aria=1) |
| pKa | Non applicabile |
| pH | Non applicabile |
Sicurezza e pericoli del tribromuro di boro
Il bromuro di boro comporta alcuni rischi per la sicurezza e occorre prestare attenzione quando si maneggia questo composto. È corrosivo per la pelle, gli occhi e il sistema respiratorio. Il contatto diretto può causare ustioni e gravi irritazioni. L’inalazione dei suoi vapori può causare disturbi respiratori. Reagisce vigorosamente con l’acqua emettendo fumi tossici. Pertanto, deve essere maneggiato in un’area ben ventilata e devono essere indossati dispositivi di protezione individuale adeguati, come guanti e occhiali. Deve essere conservato lontano da umidità e sostanze incompatibili. In caso di esposizione è necessaria l’immediata assistenza medica. È necessario seguire protocolli e linee guida di sicurezza adeguati per ridurre al minimo i rischi associati al bromuro di boro.
| Simboli di pericolo | Corrosivo, pericoloso se bagnato |
| Descrizione della sicurezza | Evitare il contatto con la pelle, gli occhi e gli indumenti. Utilizzare in un’area ben ventilata. Indossare guanti e occhiali protettivi. |
| Numeri di identificazione delle Nazioni Unite | UN3264 |
| Codice SA | 2811.19.9000 |
| Classe di pericolo | 8 |
| Gruppo di imballaggio | II |
| Tossicità | Tossico per inalazione e ingestione; provoca gravi ustioni cutanee e lesioni oculari. |
Metodi per la sintesi del tribromuro di boro
Il bromuro di boro può essere sintetizzato con vari metodi. Un metodo comune prevede la reazione tra ossido di boro (B2O3) e bromo (Br2). La reazione avviene in presenza di un catalizzatore, come carbonio o alluminio, a temperature elevate. La reazione risultante produce bromuro di boro e rilascia ossigeno gassoso.
Un altro metodo prevede la reazione tra tricloruro di boro (BCl3) e bromo. Questa reazione avviene a temperatura ambiente e forma bromuro di boro e gas di cloro come sottoprodotti.
Per preparare il bromuro di boro, il boro può essere fatto reagire con un eccesso di bromo in un ambiente controllato, che richiede temperature elevate e un attento controllo delle condizioni di reazione.
Un altro metodo consiste nel sintetizzare il bromuro di boro facendo reagire gli idruri di boro, come il diborano (B2H6) o il borano (BH3), con l’acido bromidrico (HBr). Questa reazione produce bromuro di boro e gas idrogeno come prodotti.
Tieni presente che questi metodi di sintesi richiedono cautela a causa della natura altamente reattiva del bromuro di boro. Durante il processo di sintesi è necessario seguire protocolli di sicurezza adeguati, come indossare dispositivi di protezione adeguati e lavorare in un’area ben ventilata.
Usi del tribromuro di boro
Il bromuro di boro (BBr3) ha diversi usi importanti in vari settori. Ecco alcune applicazioni chiave:
- Catalizzatore: BBr3 catalizza attivamente le reazioni di sintesi organica, consentendo processi come reazioni di acilazione, alchilazione e alogenazione.
- Intermedi chimici: BBr3 agisce come precursore nella produzione di altri composti di boro, sintetizzando reagenti contenenti boro, acidi boronici e polimeri a base di boro.
- Polimerizzazione: BBr3 partecipa attivamente alle reazioni di polimerizzazione, in particolare alla produzione di polimeri come polietilene e polipropilene, fungendo da catalizzatore dell’acido di Lewis.
- Agente dopante: l’industria dei semiconduttori utilizza attivamente BBr3 come agente dopante, modificando le proprietà elettriche del silicio per l’idoneità nei dispositivi elettronici.
- Rilevamento di gas: BBr3 reagisce attivamente con gas specifici come l’ammoniaca, rendendolo adatto per rilevatori di gas e sensori utilizzati per scopi di rilevamento e monitoraggio.
- Reagente di laboratorio: BBr3 funge attivamente da reagente in vari esperimenti e ricerche di laboratorio, eseguendo reazioni di bromurazione e agendo come fonte di atomi di bromo nella chimica sintetica.
- Sintesi farmaceutica: l’industria farmaceutica utilizza attivamente BBr3 nella sintesi di alcuni farmaci e intermedi farmaceutici.
È importante maneggiare con attenzione il bromuro di boro, seguendo i protocolli di sicurezza adeguati, a causa della sua natura corrosiva e reattiva.
Domande:
D: Quale termine descrive la reattività del tribromuro di boro (BBr3)?
R: Molto reattivo.
D: Qual è la formula del tribromuro di boro?
R: La formula del bromuro di boro è BBr3.
D: Quanti atomi di boro ci sono in 3,24 grammi di tribromuro di boro?
R: Ci sono 0,053 moli di BBr3 in 3,24 grammi, che corrispondono a 0,159 moli di boro, ovvero circa 9,62 x 10^22 atomi.
D: Quanti grammi di tribromuro di boro possono essere prodotti da 3,49 grammi di bromo?
R: La massa molare di BBr3 è 250,60 g/mol. Quindi, circa 3,49 grammi di bromo possono produrre circa 3,34 grammi di bromuro di boro.
D: Qual è il nome del composto con la formula BBr3?
R: Il composto con la formula BBr3 è chiamato bromuro di boro.
D: Il tribromuro di boro è polare o non polare?
R: Il bromuro di boro è un composto polare.
D: Qual è la geometria elettronica di BBr3?
R: La geometria elettronica di BBr3 è planare trigonale.
D: Qual è la struttura di Lewis per BBr3?
R: Nella struttura di Lewis di BBr3, c’è un atomo di boro al centro circondato da tre atomi di bromo.
D: Quanti picchi ci sono in BBr3?
R: Il bromuro di boro (BBr3) presenta un picco nel suo spettro NMR.
