Il tiosolfato di sodio è un composto chimico con la formula Na2S2O3. È comunemente usato come fissativo nell’elaborazione fotografica e come agente riducente in alcune reazioni chimiche.
| Nome IUPAC | Tiosolfato di sodio |
| Formula molecolare | Na2S2O3 |
| numero CAS | 7772-98-7 |
| Sinonimi | Iposolfito di sodio, tiosolfato di sodio, sale bisodico dell’acido tiosolfrico, tiosolfato di sodio pentaidrato |
| InChI | InChI=1S/2Na.H2O3S2/c;;1-5(2,3)4/h;;(H2,1,2,3,4)/q2*+1;/p-2 |
Proprietà del tiosolfato di sodio
Formula di tiosolfato di sodio
La formula chimica del tiosolfato di sodio è Na2S2O3. È costituito da due ioni Na+ e due ioni S2O3 2-. La formula mostra i tipi e il numero di atomi presenti in una molecola del composto.
Massa molare del tiosolfato di sodio
La massa molare di Na2S2O3 è 158,11 g/mol. Si calcola sommando le masse atomiche di tutti gli atomi presenti in una mole del composto. Questo valore è utile per determinare la quantità di Na2S2O3 necessaria per una reazione specifica o per calcolare la concentrazione di una soluzione.
Punto di ebollizione del tiosolfato di sodio
Na2S2O3 non ha un punto di ebollizione perché si decompone prima di raggiungere il punto di ebollizione. A pressione normale si decompone tra 48 e 55°C liberando anidride solforosa. Questa proprietà lo rende inadatto per applicazioni ad alta temperatura.
Tiosolfato di sodio Punto di fusione
Il punto di fusione di Na2S2O3 è 48,3°C. Questa è la temperatura alla quale il composto solido passa dallo stato liquido. Il suo punto di fusione è relativamente basso rispetto ad altri sali inorganici, il che lo rende facile da sciogliere in acqua.
Densità del tiosolfato di sodio g/mL
La densità di Na2S2O3 è 1,667 g/mL. Questo valore si riferisce alla massa della sostanza per unità di volume. È maggiore della densità dell’acqua, il che significa che Na2S2O3 affonda nell’acqua.
Peso molecolare del tiosolfato di sodio
Il peso molecolare di Na2S2O3 è 158,11 g/mol. È la somma dei pesi atomici di tutti gli atomi presenti in una molecola del composto. Il peso molecolare è utile per determinare la quantità di Na2S2O3 necessaria per una reazione specifica o per calcolare la concentrazione di una soluzione.
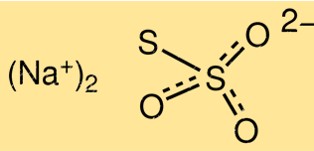
Struttura del tiosolfato di sodio
La struttura di Na2S2O3 è costituita da due ioni S2O3 2-, legati a uno ione sodio, Na+. La molecola ha una forma piramidale trigonale con un angolo di legame di circa 103 gradi. Lo ione tiosolfato ha un legame zolfo-zolfo e due legami zolfo-ossigeno.
Solubilità del tiosolfato di sodio
Na2S2O3 è molto solubile in acqua. La solubilità di Na2S2O3 in acqua aumenta con la temperatura, con circa 70 g del composto che si sciolgono in 100 ml di acqua a 25°C. È anche solubile in glicerolo e leggermente solubile in alcool. La sua solubilità lo rende utile in varie applicazioni, come l’elaborazione fotografica e i trattamenti medici.
| Aspetto | Polvere cristallina bianca |
| Peso specifico | 1.667 g/ml |
| Colore | Da incolore a bianco |
| Odore | Inodore |
| Massa molare | 158,11 g/mole |
| Densità | 1.667 g/ml |
| Punto di fusione | 48,3°C |
| Punto di ebollizione | Si rompe prima dell’ebollizione |
| Punto flash | Non applicabile |
| solubilità in acqua | Molto solubile |
| Solubilità | Solubile in glicerolo e leggermente solubile in alcool |
| Pressione del vapore | Non applicabile |
| Densità del vapore | Non applicabile |
| pKa | Non applicabile |
| pH | Neutro (pH 7) |
Sicurezza e pericoli del tiosolfato di sodio
Na2S2O3 è generalmente considerato sicuro se maneggiato correttamente. Tuttavia può essere dannoso se ingerito, inalato o se entra in contatto con gli occhi o la pelle. Il composto può causare irritazione alla pelle e agli occhi e un’esposizione prolungata può provocare dermatiti. L’ingestione di Na2S2O3 può causare disturbi gastrointestinali, come nausea e vomito. È importante indossare dispositivi di protezione individuale adeguati, come guanti e occhiali di sicurezza, quando si lavora con Na2S2O3. Se esposta, l’area interessata deve essere lavata con acqua e, se necessario, consultare un medico.
| Simboli di pericolo | Nessuno |
| Descrizione della sicurezza | Evitare il contatto con gli occhi, la pelle e gli indumenti. Non ingerire. Indossare adeguati dispositivi di protezione individuale. |
| Numeri di identificazione delle Nazioni Unite | UN3077 |
| Codice SA | 2832.3010.00 |
| Classe di pericolo | 9 |
| Gruppo di imballaggio | III |
| Tossicità | Bassa tossicità; La LD50 (orale, ratto) è 6.200 mg/kg |
Metodi per la sintesi del tiosolfato di sodio
Vari metodi possono sintetizzare Na2S2O3.
Un metodo comune consiste nel far reagire il solfito di sodio con lo zolfo in presenza di una soluzione alcalina. Un altro metodo prevede la reazione del solfito di sodio con l’anidride solforosa sotto pressione.
Un metodo per preparare Na2S2O3 consiste nel sciogliere lo zolfo in una soluzione calda di solfito di sodio e idrossido di sodio . La soluzione si raffredda e qualcuno la filtra per ottenere un prodotto solido.
In questo metodo, l’anidride solforosa viene fatta reagire con l’idrossido di sodio per produrre solfito di sodio, quindi viene fatta reagire con lo zolfo elementare per produrre Na2S2O3.
Per produrre Na2S2O3, l’acido solforico può essere fatto reagire con solfito di sodio, quindi riscaldare la soluzione risultante e aggiungere zolfo. Il solfito di sodio reagirà quindi con lo zolfo per formare Na2S2O3.
Un altro metodo prevede la reazione dell’idrossido di sodio con lo zolfo, seguita dall’aggiunta di solfito di sodio per formare Na2S2O3.
Usi del tiosolfato di sodio
Na2S2O3 ha un’ampia gamma di usi in vari settori e applicazioni, tra cui:
- Fotografia: utilizzato come agente fissativo per rimuovere l’alogenuro d’argento non esposto da stampe e pellicole fotografiche.
- Trattamento dell’acqua: utilizzato per declorare l’acqua neutralizzando il cloro e prevenendo i suoi effetti dannosi sulla vita acquatica.
- Applicazioni mediche: utilizzato nel trattamento dell’avvelenamento da cianuro perché reagisce con il cianuro per formare tiocianato, che è meno tossico e può essere escreto dal corpo.
- Applicazioni industriali: utilizzato come agente riducente nei processi chimici e come conservante nei tessuti, nella pelle e nella carta.
- Chimica analitica: utilizzato come titolante nell’analisi di vari metalli, come rame e arsenico.
- Industria alimentare e delle bevande: utilizzato come conservante alimentare per prevenire lo scolorimento e come esaltatore di sapidità.
- Orticoltura: Utilizzato per neutralizzare gli effetti del cloro nell’acqua utilizzata per l’irrigazione delle piante.
Domande:
D: A cosa serve il tiosolfato di sodio?
R: Na2S2O3 ha una vasta gamma di applicazioni, tra cui fotografia, trattamento delle acque, trattamenti medici, processi industriali, chimica analitica, conservazione di alimenti e bevande e orticoltura.
D: Come preparare il tiosolfato di sodio?
R: Na2S2O3 può essere sintetizzato facendo reagire il solfito di sodio con lo zolfo o l’anidride solforosa in presenza di una soluzione alcalina. Altri metodi prevedono la reazione dell’idrossido di sodio con lo zolfo o l’anidride solforosa per produrre solfito di sodio, che poi reagisce con lo zolfo per produrre Na2S2O3.
D: Cos’è il tiosolfato di sodio e oro?
R: L’oro Na2S2O3 è un composto complesso formato dalla reazione del cloruro d’oro e Na2S2O3. Viene utilizzato nella placcatura in oro e nella chimica analitica per rilevare e quantificare l’oro.
D: Dove acquistare il tiosolfato di sodio?
R: Na2S2O3 può essere acquistato da fornitori di prodotti chimici, società di forniture di laboratorio e rivenditori online.
D: Dove posso trovare il tiosolfato di sodio?
R: Na2S2O3 può essere trovato in una varietà di prodotti, inclusi prodotti chimici per la fotografia, prodotti per il trattamento dell’acqua e trattamenti medici.
D: Qual è il numero di ossidazione dello zolfo in Na2S2O3?
R: Il numero di ossidazione dello zolfo in Na2S2O3 è +2 nello ione tiosolfato (S2O3^2-) e +6 nello ione solfato (SO4^2-).
D: Come trovare il peso del Cu dalla titolazione di Na2S2O3?
R: Il peso di Cu può essere calcolato dal volume e dalla molarità della soluzione Na2S2O3 utilizzata nella titolazione, utilizzando l’equazione chimica bilanciata per la reazione tra Cu e Na2S2O3.
D: Come si fa a sapere quando è stata aggiunta una quantità stechiometrica di Na2S2O3?
R: Una quantità stechiometrica di Na2S2O3 è stata aggiunta quando viene raggiunto il punto finale della reazione, come indicato da un cambiamento di colore o da altre proprietà fisiche o chimiche.
D: Se si aggiungono 5 gocce di KI 0,15 M a 40 gocce di Na2S2O3, qual è la concentrazione finale di KI?
R: La concentrazione finale di KI non può essere determinata senza informazioni aggiuntive, come il volume o la concentrazione della soluzione Na2S2O3.
D: Come trovare la molarità di Na2S2O3?
R: La molarità di Na2S2O3 può essere calcolata dalla massa del campione, dal volume e dalla concentrazione della soluzione utilizzata per dissolverlo, utilizzando la formula Molarità = moli di soluto/volume di soluzione in litri.
