Il tetrafluoroetilene o C2F4 è un gas incolore e inodore utilizzato nella produzione di fluoropolimeri come il Teflon. Viene utilizzato anche nella produzione di refrigeranti e propellenti.
| Nome dell’IUPAC | Tetrafluoroetilene |
| Formula molecolare | C2F4 |
| numero CAS | 116-14-3 |
| Sinonimi | TFE, perfluoroetilene, etene, tetrafluoro-, F4E, freon 1113, halocarbon 1113 |
| InChI | InChI=1S/C2F4/c3-1(4)2(5)6 |
Struttura di Lewis C2F4
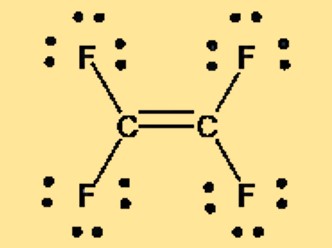
La struttura di Lewis del tetrafluoroetilene, nota anche come TFE o C2F4, può essere rappresentata da due atomi di carbonio doppiamente legati tra loro, con ciascun atomo di carbonio legato a due atomi di fluoro. La struttura di Lewis mostra la disposizione degli elettroni di valenza nella molecola e fornisce informazioni sul legame e sulla geometria della molecola. La natura non polare del TFE è evidente anche nella sua struttura di Lewis, che non presenta separazione di carica o momento dipolare netto.
Massa molare del tetrafluoroetilene
La massa molare del tetrafluoroetilene, chiamato anche TFE o C2F4, è 100,02 g/mol. Questo valore si calcola sommando le masse atomiche di tutti gli elementi presenti nella molecola, che sono due atomi di carbonio e quattro atomi di fluoro. La massa molare è un parametro importante per determinare la quantità di una sostanza presente in un dato volume o massa e viene utilizzata anche nei calcoli stechiometrici.
Punto di ebollizione del tetrafluoroetilene
Il tetrafluoroetilene ha un punto di ebollizione di -76,3°C (-105,34°F) a pressione standard. È un gas molto volatile che può vaporizzare rapidamente a temperatura ambiente e pressione atmosferica. Il basso punto di ebollizione del TFE lo rende ideale per varie applicazioni industriali come nei sistemi di refrigerazione e come propellente per aerosol.
Punto di fusione del tetrafluoroetilene
Il tetrafluoroetilene non ha un punto di fusione distinto perché subisce una transizione di fase direttamente da solido a gassoso, saltando la fase liquida. Tuttavia, la forma solida del TFE può esistere a temperature inferiori a -76,3°C in condizioni di alta pressione. Anche la forma solida del TFE è molto instabile e reattiva e può polimerizzare o decomporsi spontaneamente.
Densità del tetrafluoroetilene g/ml
La densità del tetrafluoroetilene a temperatura e pressione standard (STP) è 1,47 g/L. Tuttavia, poiché il TFE è un gas, la sua densità può variare in modo significativo al variare della temperatura e della pressione. A temperatura ambiente e pressione atmosferica, la densità del TFE è di circa 3,21 g/L.
Peso molecolare del tetrafluoroetilene
Il peso molecolare di C2F4 è 100,02 g/mol. Questo valore si calcola sommando i pesi atomici di tutti gli atomi presenti nella molecola. Il TFE ha un peso molecolare relativamente basso, che contribuisce alla sua elevata volatilità e al basso punto di ebollizione.
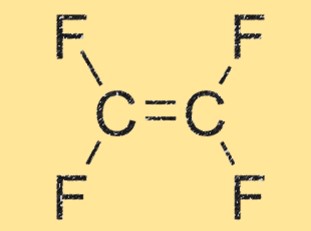
Struttura C2F4
C2F4 ha una struttura lineare, con due atomi di carbonio doppiamente legati tra loro e ciascuno legato a due atomi di fluoro. La molecola è altamente simmetrica e non ha momento dipolare netto, rendendola non polare. La geometria lineare del TFE contribuisce anche alla sua elevata reattività e capacità di formare catene polimeriche.
Formula C2F4
La formula chimica di C2F4 è C2F4, che indica che la molecola contiene due atomi di carbonio e quattro atomi di fluoro. La formula fornisce informazioni sui tipi e sul numero di atomi presenti nella molecola, che possono essere utili per prevederne il comportamento chimico e le reazioni.
| Aspetto | Gas incolore |
| Peso specifico | 1,47 g/l a STP |
| Colore | Incolore |
| Odore | Inodore |
| Massa molare | 100,02 g/mole |
| Densità | 3,21 g/L a temperatura ambiente e pressione atmosferica |
| Punto di fusione | Non ha un punto di fusione distinto |
| Punto di ebollizione | -76,3°C (-105,34°F) a pressione standard |
| Punto flash | Non applicabile perché il TFE è un gas |
| solubilità in acqua | Insolubile |
| Solubilità | Solubile in alcuni solventi organici come acetone e cloroformio |
| Pressione del vapore | 209,7 kPa a 20°C |
| Densità del vapore | 2,95 (aria = 1) |
| pKa | Non applicabile, poiché il TFE non è né un acido né una base |
| pH | Non applicabile, poiché il TFE non è né un acido né una base |
Sicurezza e pericoli del tetrafluoroetilene
Il tetrafluoroetilene può comportare numerosi rischi per la sicurezza e la salute se non maneggiato correttamente. L’esposizione ad alte concentrazioni di TFE può causare irritazione agli occhi, alla pelle e alle vie respiratorie. L’esposizione prolungata può anche portare a danni ai polmoni, inclusi edema polmonare e polmonite. Il TFE è anche un gas infiammabile che può formare miscele esplosive con l’aria. Pertanto deve essere immagazzinato e trasportato in contenitori specializzati per evitare il rischio di incendio o esplosione. È importante utilizzare dispositivi di protezione adeguati, inclusa la protezione respiratoria, quando si maneggia il TFE per prevenire l’esposizione e ridurre al minimo il rischio di effetti avversi sulla salute.
| Simboli di pericolo | F+ (altamente infiammabile) |
| Descrizione della sicurezza | Gas altamente infiammabile. Provoca grave irritazione oculare. Può causare irritazione respiratoria. |
| Numeri di identificazione delle Nazioni Unite | UN1080 |
| Codice SA | 2903.39 |
| Classe di pericolo | 2.1 (Gas infiammabile) |
| Gruppo di imballaggio | Non applicabile perché il TFE è un gas |
| Tossicità | Il TFE ha una bassa tossicità acuta, ma l’esposizione prolungata può portare a danni ai polmoni e altri effetti avversi sulla salute. Il TFE è anche considerato un potenziale cancerogeno per l’uomo. |
Metodi per la sintesi del tetrafluoroetilene
Il tetrafluoroetilene (TFE) può essere sintetizzato con diversi metodi, inclusa la decomposizione termica e catalitica di vari composti fluorocarburici.
Un metodo comune per sintetizzare il TFE è la decomposizione termica del clorodifluorometano (CCl2F2) in presenza di un adatto iniziatore ad alta temperatura. Il processo prevede la rottura dei legami carbonio-cloro nel CCl2F2 per formare un radicale, che poi reagisce con altre molecole per produrre TFE.
Un altro metodo è la decomposizione catalitica di composti fluorocarburici come esafluoropropene (HFP) o ottafluorociclobutano (OFCB) su un catalizzatore adatto, come cloruro di alluminio o pentafluoruro di antimonio, ad alta temperatura. Questo metodo produce una miscela di TFE e altri sottoprodotti di fluorocarburi, che vengono poi separati e purificati.
Inoltre, il TFE può essere sintetizzato mediante fluorurazione elettrochimica, un processo che prevede il passaggio di una miscela di idrogeno e fluoro gassoso su un anodo metallico in presenza di un elettrolita. Questo metodo produce una miscela di TFE e altri composti fluorurati, che vengono poi separati e purificati.
Nel complesso, la sintesi del TFE richiede attrezzature e competenze specializzate a causa della natura altamente reattiva e pericolosa delle sostanze chimiche coinvolte. Pertanto, è importante seguire protocolli e normative di sicurezza adeguati durante la sintesi del TFE.
Usi del tetrafluoroetilene
Il tetrafluoroetilene (TFE) è una sostanza chimica versatile con diverse applicazioni industriali e commerciali.
- Uno degli usi principali del TFE è come monomero per la produzione di politetrafluoroetilene (PTFE), un polimero antiaderente e resistente al calore comunemente noto come Teflon.
- Il TFE funge da materia prima per produrre altri composti fluorurati, come acidi carbossilici perfluorurati e perfluoroalchil solfonati, che hanno applicazioni nell’elettronica, nel tessile e in altri settori.
- Il TFE svolge un ruolo cruciale nella produzione di fluoropolimeri, come il fluoruro di polivinilidene (PVDF), che sono ampiamente utilizzati in rivestimenti, tubi e fili grazie alla loro elevata resistenza chimica e durata.
- I produttori utilizzano il TFE come refrigerante nei sistemi di condizionamento e refrigerazione e nella produzione di materiali isolanti in schiuma.
- L’industria farmaceutica utilizza il TFE come solvente e propellente per formulazioni aerosol.
- Il TFE ha molte applicazioni, tra cui rivestimenti per pentole, isolamento elettrico e guarnizioni ad alte prestazioni.
Nel complesso, la versatilità e le proprietà uniche del TFE lo rendono un prodotto chimico prezioso in un’ampia gamma di applicazioni industriali e commerciali. Tuttavia, è importante seguire protocolli e normative di sicurezza adeguati quando si maneggia il TFE per ridurre al minimo il rischio di effetti avversi sulla salute e danni ambientali.
Domande:
Quali orbitali atomici o ibridi costituiscono il legame sigma tra c2 e f nel tetrafluoroetilene, c2f4?
Il legame sigma tra C2 e F nel tetrafluoroetilene (C2F4) è formato dalla sovrapposizione di orbitali ibridi. In C2F4, ciascun atomo di carbonio è ibridato sp2, il che significa che i suoi tre orbitali atomici (un orbitale 2s e due orbitali 2p) si combinano per formare tre orbitali ibridati sp2, disposti in una geometria planare trigonale. Ogni atomo di carbonio ha anche un orbitale 2p non ibridato, perpendicolare al piano degli orbitali sp2.
L’atomo di fluoro ha un orbitale 2p occupato singolarmente che si sovrappone all’orbitale 2p non ibridato dell’atomo di carbonio adiacente per formare il legame sigma. Questa sovrapposizione avviene end-to-end tra i due atomi, risultando in una disposizione lineare degli atomi nella molecola. Gli elettroni nel legame sigma si trovano principalmente nella regione tra i due nuclei, creando un forte legame covalente tra gli atomi di carbonio e fluoro.
Il Teflon è prodotto da tetrafluoroetilene polimerizzato?
Sì, il Teflon è prodotto dalla polimerizzazione del tetrafluoroetilene (TFE). Il TFE è un gas incolore e inodore che può essere polimerizzato in presenza di un catalizzatore per formare politetrafluoroetilene (PTFE), comunemente noto come Teflon.
Il processo di polimerizzazione prevede l’avvio della reazione utilizzando un iniziatore di radicali liberi come il persolfato di ammonio o l’azobisisobutirronitrile (AIBN), che genera radicali liberi che avviano la reazione a catena dei monomeri di TFE polimerizzati in PTFE.
