Il tetracloruro di carbonio è un liquido incolore con un odore dolce. Era comunemente usato come solvente, ma la sua produzione e il suo utilizzo sono diminuiti a causa dei suoi effetti dannosi sulla salute e sull’ambiente.
| Nome IUPAC | Tetraclorometano |
| Formula molecolare | CCl4 |
| numero CAS | 56-23-5 |
| Sinonimi | Tet carbonio, Tetraform, Perclorometano, Tetrasol |
| InChI | InChI=1S/CCl4/c2-1(3,4)5 |
Proprietà del tetracloruro di carbonio
Formula del tetracloruro di carbonio
La formula chimica del tetracloruro di carbonio è CCl4. Rappresenta una molecola composta da un atomo di carbonio legato a quattro atomi di cloro. La formula fornisce informazioni essenziali sulla composizione elementare e sulla disposizione degli atomi all’interno del composto.
Massa molare del tetracloruro di carbonio
La massa molare del tetraclorometano si calcola sommando le masse atomiche dei suoi elementi costitutivi. Il carbonio ha una massa molare di 12,01 g/mol, mentre il cloro ha una massa molare di 35,45 g/mol. Sommando questi valori, la massa molare del tetraclorometano è di circa 153,82 g/mol.
Punto di ebollizione del tetracloruro di carbonio
Il tetraclorometano ha un punto di ebollizione relativamente alto di 76,72°C (170,1°F). Ciò significa che a pressione atmosferica standard, il composto cambia da liquido a gas a quella temperatura. Il punto di ebollizione riflette la forza delle forze intermolecolari all’interno della sostanza.
Tetracloruro di carbonio Punto di fusione
Il punto di fusione del tetraclorometano è -22,92°C (-9,26°F). Questa è la temperatura alla quale la forma solida del composto si trasforma in liquida. Il punto di fusione fornisce informazioni sulla forza dei legami che tengono insieme gli atomi all’interno del reticolo cristallino.
Densità del tetracloruro di carbonio g/mL
La densità del tetraclorometano è di circa 1,586 g/mL. La densità si riferisce alla massa di una sostanza per unità di volume. La densità del tetraclorometano indica che è più denso dell’acqua, che ha una densità di 1 g/mL.
Peso molecolare del tetracloruro di carbonio
Il peso molecolare del tetraclorometano viene calcolato sommando i pesi atomici dei suoi atomi costituenti. Con un atomo di carbonio (12,01 g/mol) e quattro atomi di cloro (35,45 g/mol ciascuno), il peso molecolare del tetraclorometano è di circa 153,82 g/mol.
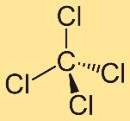
Struttura del tetracloruro di carbonio
La struttura del tetraclorometano è costituita da un atomo di carbonio centrale legato a quattro atomi di cloro. Questi atomi di cloro sono posizionati simmetricamente attorno all’atomo di carbonio, formando una geometria tetraedrica. Questa struttura contribuisce alle proprietà e al comportamento del composto.
Solubilità del tetracloruro di carbonio
Il tetraclorometano è scarsamente solubile in acqua, con una solubilità di circa 0,8 g/L a 20°C. Tuttavia, mostra una maggiore solubilità in solventi organici come etanolo, etere e benzene. Le caratteristiche di solubilità sono influenzate dalle forze intermolecolari e dalla polarità delle sostanze coinvolte.
| Aspetto | Liquido incolore |
| Peso specifico | 1.586 |
| Colore | N / A |
| Odore | Morbido |
| Massa molare | 153,82 g/mole |
| Densità | 1.586 g/ml |
| Punto di fusione | -22,92°C (-9,26°F) |
| Punto di ebollizione | 76,72°C (170,1°F) |
| Punto flash | N / A |
| solubilità in acqua | 0,8 g/l a 20°C |
| Solubilità | Solubile in solventi organici come etanolo, etere e benzene |
| Pressione del vapore | 11,9 mmHg a 20°C |
| Densità del vapore | 5.3 (aria = 1) |
| pKa | N / A |
| pH | N / A |
Sicurezza e pericoli del tetracloruro di carbonio
Il tetraclorometano presenta notevoli rischi per la sicurezza. È considerato altamente tossico e può danneggiare gravemente la salute umana. L’inalazione dei suoi vapori può causare irritazione respiratoria, vertigini, nausea e persino danni al fegato e ai reni. Il contatto della pelle con il liquido può causare ustioni e irritazioni. Il composto è anche un noto cancerogeno, che comporta rischi per la salute a lungo termine. Inoltre, il tetraclorometano è pericoloso per l’ambiente, con il potenziale di contaminare il suolo e l’acqua. A causa di questi pericoli, la sua produzione e il suo utilizzo sono stati significativamente limitati al fine di ridurre al minimo l’esposizione e proteggere sia la salute umana che l’ambiente. È necessario seguire protocolli adeguati di manipolazione, stoccaggio e smaltimento per mitigare i rischi associati al tetraclorometano.
| Simboli di pericolo | T,Xn |
| Descrizione della sicurezza | Molto tossico; Dannoso |
| Numeri di identificazione delle Nazioni Unite | Un 1846 |
| Codice SA | 2903.14.0000 |
| Classe di pericolo | 6.1 (Sostanze tossiche) |
| Gruppo di imballaggio | II |
| Tossicità | Tossicità acuta, Cancerogeno |
Metodi per la sintesi del tetracloruro di carbonio
Il tetraclorometano può essere sintetizzato con diversi metodi. Un metodo comune prevede la reazione tra cloro gassoso (Cl2) e disolfuro di carbonio (CS2) in presenza di un catalizzatore come il cloruro di alluminio (AlCl3).
In questo processo, il gas di cloro reagisce con i vapori di disolfuro di carbonio per produrre tetraclorometano e zolfo. La reazione procede come segue:
Cl2 + CS2 → CCl4 + S
Un altro metodo prevede la reazione tra metano (CH4) e cloro gassoso. In condizioni controllate, il metano reagisce con il cloro in presenza di luce ultravioletta (UV) o calore per produrre tetraclorometano e acido cloridrico. La reazione procede come segue:
CH4 + 4Cl2 → CCl4 + 4HCl
La clorazione del disolfuro di carbonio utilizzando acido cloridrico (HCl) come agente clorurante produce tetraclorometano. Questa reazione richiede un catalizzatore, come il cloruro di ferro (III) (FeCl3). La reazione procede come segue:
CS2 + 3HCl + FeCl3 → CCl4 + S + 2FeCl2
Quando si sintetizzano il tetraclorometano, gli individui dovrebbero prestare attenzione a causa della natura pericolosa del composto. Devono utilizzare rigorose misure di sicurezza e attrezzature adeguate per garantire il loro benessere e prevenire la contaminazione ambientale.
Usi del tetracloruro di carbonio
Varie applicazioni hanno utilizzato le proprietà uniche del tetraclorometano. Ecco alcuni dei suoi usi:
- Solvente: il tetraclorometano una volta disciolto oli, grassi, gomma e cere, funge da solvente. Tuttavia, la sua tossicità e le preoccupazioni ambientali hanno ridotto significativamente l’uso di solventi.
- Estintore: tetraclorometano utilizzato per estinguere alcuni tipi di incendi che coinvolgono apparecchiature elettriche e liquidi infiammabili. Alternative più sicure e i loro effetti dannosi hanno portato al graduale abbandono del suo utilizzo.
- Intermedio chimico: il tetraclorometano è servito come intermedio chimico nella produzione di vari composti, come refrigeranti, pesticidi e prodotti farmaceutici.
- Agente detergente: le industrie precedentemente utilizzavano il tetraclorometano come detergente per superfici metalliche e componenti elettronici. Tuttavia, i rischi per la salute e l’ambiente hanno spinto a preferire alternative più sicure.
- Reagente di laboratorio: il tetraclorometano viene talvolta utilizzato come reagente o solvente per reazioni ed estrazioni specifiche in laboratorio. I chimici generalmente preferiscono alternative più sicure e ne limitano l’uso.
È fondamentale notare che molte di queste applicazioni sono diminuite, o addirittura cessate del tutto, a causa degli effetti dannosi del tetraclorometano sulla salute umana e sull’ambiente. Di conseguenza, l’uso del tetraclorometano è diminuito notevolmente e in diversi settori sono state adottate sostanze alternative meno tossiche e meno impattanti sull’ambiente.
Domande:
D: È ancora possibile acquistare sostituti del tetracloruro di carbonio?
R: Sì, esistono sostituti del tetraclorometano che sono più sicuri e hanno un impatto ambientale inferiore.
D: Puoi ancora acquistare il tetracloruro di carbonio?
R: Il tetraclorometano è soggetto a restrizioni in molti paesi a causa della sua tossicità e dei rischi ambientali, quindi la sua disponibilità per l’acquisto è limitata.
D: Il tetracloruro di carbonio è legale?
R: Il tetraclorometano è soggetto a restrizioni legali in molti paesi a causa dei suoi effetti dannosi sulla salute e sull’ambiente.
D: Il tetracloruro di carbonio è alcalino o acido?
R: Il tetraclorometano non è né alcalino né acido; è un composto neutro.
D: Il tetracloruro di carbonio è polare o non polare?
R: Il tetraclorometano è una molecola non polare a causa della sua struttura tetraedrica simmetrica, che si traduce in un’equa condivisione degli elettroni.
D: Qual è la massa molare del tetracloruro di carbonio?
R: La massa molare del tetraclorometano è circa 153,82 g/mol.
D: Cos’è il tetracloruro di carbonio?
R: Il tetraclorometano è un composto liquido incolore utilizzato in passato principalmente come solvente, ma il suo utilizzo è ora limitato a causa della sua tossicità e dei problemi ambientali.
D: Qual è la formula chimica del tetracloruro di carbonio?
R: La formula chimica del tetraclorometano è CCl4.
D: Il legame è in tetracloruro di carbonio?
R: Il legame nel tetraclorometano è covalente, con quattro legami covalenti tra l’atomo di carbonio centrale e gli atomi di cloro circostanti.
D: Il tetracloruro di carbonio è ionico o covalente?
R: Il tetraclorometano è un composto covalente perché forma legami condividendo gli elettroni tra gli atomi di carbonio e di cloro.
D: Quanti atomi di cloro ci sono nella molecola del tetracloruro di carbonio?
R: Ci sono quattro atomi di cloro nella molecola del tetraclorometano.
D: Per ogni soluto, identificare il solvente migliore: acqua o tetracloruro di carbonio?
R: Il miglior solvente dipende dal soluto. L’acqua è generalmente un solvente migliore per le sostanze polari, mentre il tetraclorometano è migliore per le sostanze non polari.
D: Struttura di Lewis del tetraclorometano?
R: Nella struttura di Lewis del tetraclorometano, l’atomo di carbonio centrale è legato a quattro atomi di cloro, senza coppie solitarie sull’atomo di carbonio centrale.
