Il tetracloroetilene (C2Cl4) è un liquido incolore e non infiammabile comunemente utilizzato nel lavaggio a secco. Può causare problemi di salute come vertigini, mal di testa e danni al fegato se ingerito o inalato eccessivamente.
| Nome IUPAC | Tetracloroetilene |
| Formula molecolare | C2Cl4 |
| numero CAS | 127-18-4 |
| Sinonimi | Percloroetilene, PCE, tetracloroetilene, dimero di tetracloruro di carbonio, 1,1,2,2-tetracloroetilene |
| InChI | InChI=1S/C2Cl4/c3-1(4)2(5)6 |
Proprietà del tetracloroetilene
Formula del tetracloroetilene
Il tetracloroetilene, noto anche come percloroetilene o PCE, ha una formula chimica C2Cl4. Ciò significa che ciascuna molecola di tetracloroetilene è composta da due atomi di carbonio e quattro atomi di cloro. La formula è importante perché ci aiuta a comprendere la struttura molecolare e le proprietà del tetracloroetilene.
Massa molare del tetracloroetilene
La massa molare di C2Cl4 è 165,83 g/mol. Ciò significa che una mole di C2Cl4, che equivale a 6,022 x 10^23 molecole, pesa 165,83 grammi. La massa molare è importante nei calcoli chimici e può aiutare a determinare la quantità di C2Cl4 necessaria per una reazione specifica.
Punto di ebollizione del tetracloroetilene
Il punto di ebollizione di C2Cl4 è 121,1°C (250°F). Ciò significa che ad una temperatura di 121,1°C, C2Cl4 passerà da liquido a gassoso. Il punto di ebollizione è una proprietà importante perché influenza il comportamento di C2Cl4 in diversi ambienti.
Punto di fusione del tetracloroetilene
Il punto di fusione di C2Cl4 è -22,94°C (-9,31°F). Ciò significa che a una temperatura inferiore a -22,94°C, C2Cl4 cambierà da solido a liquido. Il punto di fusione è importante per determinare lo stato fisico di C2Cl4 a diverse temperature.
Densità del tetracloroetilene g/mL
La densità di C2Cl4 è 1,62 g/mL a temperatura ambiente. Ciò significa che C2Cl4 è più denso dell’acqua, che ha una densità di 1 g/mL. La densità è importante per comprendere le proprietà fisiche di C2Cl4 e come si comporta in diversi ambienti.
Peso molecolare del tetracloroetilene
Il peso molecolare di C2Cl4 è 165,83 g/mol. Ciò significa che il peso di una molecola di C2Cl4 è 165,83 unità di massa atomica. Il peso molecolare è importante nei calcoli chimici e può aiutare a determinare la quantità di C2Cl4 necessaria per una reazione specifica.
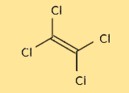
Struttura del tetracloroetilene
La struttura di C2Cl4 è costituita da due atomi di carbonio e quattro atomi di cloro disposti in forma tetraedrica. Gli atomi di carbonio sono uniti da un doppio legame, mentre ciascun atomo di cloro è legato a uno degli atomi di carbonio. La struttura è importante per comprendere le proprietà chimiche e fisiche di C2Cl4.
Solubilità del tetracloroetilene
C2Cl4 è insolubile in acqua, ma è solubile in solventi organici come alcool ed etere. Ciò significa che C2Cl4 non si dissolve in acqua, ma può dissolversi in altre sostanze. La solubilità è importante per comprendere il comportamento di C2Cl4 in diversi ambienti, come in ambienti industriali o in laboratorio.
| Aspetto | Liquido incolore |
| Peso specifico | 1,62 a 20°C |
| Colore | Incolore |
| Odore | Odore dolce ed etereo |
| Massa molare | 165,83 g/mole |
| Densità | 1,62 g/ml a 20°C |
| Punto di fusione | -22,94°C |
| Punto di ebollizione | 121,1°C |
| Punto flash | 55°C |
| solubilità in acqua | 0,015 g/100 ml a 25°C |
| Solubilità | Solubile in alcool ed etere |
| Pressione del vapore | 10 mmHg a 20°C |
| Densità del vapore | 5.7 |
| pKa | 1.8 |
| pH | Non applicabile (sostanza pura) |
Sicurezza e pericoli del tetracloroetilene
C2Cl4 può essere dannoso se inalato, ingerito o entra in contatto con la pelle o gli occhi. Ciò può causare vertigini, mal di testa, confusione e irritazione respiratoria. L’esposizione a lungo termine può causare danni al fegato e ai reni e aumentare il rischio di alcuni tumori. È importante maneggiare C2Cl4 con cura e utilizzare dispositivi di protezione adeguati quando si lavora con esso. La sostanza deve essere conservata in un’area ben ventilata e tenuta lontana da fonti di calore o ignizione. Le fuoriuscite devono essere immediatamente ripulite e smaltite adeguatamente in conformità con le normative locali.
| Simboli di pericolo | Teschio e Ossa Incrociate, Fiamma |
| Descrizione della sicurezza | Facilmente infiammabile, Tossico se inalato o ingerito, Può provocare il cancro, Può provocare danni agli organi |
| UN ID | Un 1897 |
| Codice SA | 290323 |
| Classe di pericolo | 6.1 (Sostanze tossiche) |
| Gruppo di imballaggio | III |
| Tossicità | Il tetracloroetilene è classificato come cancerogeno del gruppo 2A (probabilmente cancerogeno per l’uomo) dall’Agenzia internazionale per la ricerca sul cancro (IARC) e come tossina riproduttiva di categoria 2 dall’Unione Europea. |
Metodi per la sintesi del tetracloroetilene
Per sintetizzare C2Cl4, si possono utilizzare vari metodi, come la clorurazione diretta dell’etilene , la clorurazione del dicloruro di etilene o la clorurazione del tetracloruro di carbonio.
Il gas etilene reagisce con il cloro gassoso in un reattore per formare C2Cl4 durante il metodo di clorazione diretta. Questo metodo può produrre rese elevate di C2Cl4 ma richiede un attento controllo delle condizioni di reazione per evitare sottoprodotti indesiderati.
Il secondo metodo prevede la clorurazione del dicloruro di etilene, che è un sottoprodotto della produzione del cloruro di vinile. Anche questo metodo produce rese elevate di C2Cl4 ma può provocare la formazione di sottoprodotti tossici come l’esaclorobutadiene.
Il terzo metodo prevede la clorurazione del tetracloruro di carbonio, che può produrre C2Cl4 come sottoprodotto. Tuttavia, questo metodo è meno efficiente e produce rendimenti inferiori rispetto agli altri due metodi.
Oltre a questi metodi, è anche possibile produrre C2Cl4 facendo reagire il tricloroetilene con cloro gassoso o facendo reagire l’esacloroetano con fosgene.
Su scala industriale, i produttori utilizzano comunemente la clorurazione diretta dell’etilene e la clorazione con dicloruro di etilene come metodi più comunemente utilizzati per produrre C2Cl4.
Usi del tetracloroetilene
C2Cl4 ha diversi usi industriali e commerciali, tra cui:
- Lavaggio a secco: ampiamente utilizzato come solvente per il lavaggio a secco degli indumenti grazie alla sua capacità di dissolvere un’ampia gamma di macchie e sporco.
- Sgrassaggio dei metalli: un solvente efficace per rimuovere olio e grasso dalle superfici metalliche, rendendolo utile nell’industria della lavorazione dei metalli.
- Adesivi e sigillanti: utilizzato come solvente nella produzione di adesivi e sigillanti perché può sciogliere molti tipi di polimeri e resine.
- Intermedi chimici: utilizzati come materia prima nella produzione di altri prodotti chimici, come solventi clorurati e fluorocarburi.
- Lavorazione tessile e della pelle: utilizzato nella lavorazione tessile e della pelle come solvente e per rimuovere le impurità.
- Refrigerante: alcune applicazioni utilizzano C2Cl4 come refrigerante, ma le preoccupazioni ambientali stanno gradualmente eliminando questo utilizzo.
- Solvente da laboratorio: utilizzato anche come solvente da laboratorio, in particolare per applicazioni di cromatografia e spettroscopia.
Domande:
D: Cos’è il tetracloroetilene?
R: C2Cl4, noto anche come percloroetilene o PCE, è un liquido incolore con un odore delicato ampiamente utilizzato come solvente in varie applicazioni industriali e commerciali.
D: Il tetracloroetilene galleggia sull’acqua?
R: No, C2Cl4 è più denso dell’acqua, quindi affonderà e formerà uno strato distinto sul fondo.
D: Dove acquistare il solvente per il lavaggio a secco del tetracloroetilene (percloroetilene)?
R: C2Cl4 è una sostanza regolamentata e può essere acquistata solo da professionisti autorizzati nel settore del lavaggio a secco. Di solito viene acquistato da fornitori o distributori chimici specializzati in solventi industriali.
D: Qual è la relazione tra tetracloroetilene e tetracloruro di carbonio?
R: C2Cl4 e tetracloruro di carbonio sono entrambi idrocarburi alogenati che contengono atomi di cloro, ma hanno strutture e proprietà molecolari diverse. Il tetracloruro di carbonio è una molecola non polare, mentre C2Cl4 è polare a causa della presenza di un doppio legame tra due atomi di carbonio.
D: Tetracloroetilene in acqua?
R: C2Cl4 è solo leggermente solubile in acqua e tende a ripartirsi nel suolo e nei sedimenti, rendendolo un contaminante comune delle falde acquifere e del suolo.
D: Aziende che effettuano test sul tetracloroetilene?
R: Molte società di analisi ambientali offrono servizi di analisi C2Cl4 per campioni di acqua, suolo e aria. Alcuni esempi includono ALS Global, Eurofins TestAmerica e Environmental Testing and Consulting, Inc.
D: Cos’è l’ibridazione degli atomi di C in C2Cl4?
R: Gli atomi di C in C2Cl4 hanno ibridazione sp2, il che significa che hanno tre orbitali ibridi coinvolti nel legame con altri atomi.
D: Qual è l’angolo approssimativo del legame cloro-carbonio-cloro in C2Cl4?
R: L’angolo approssimativo del legame cloro-carbonio-cloro in C2Cl4 è di 120 gradi, che è caratteristico delle molecole con geometria planare trigonale.
D: C2Cl4 è polare o non polare?
R: C2Cl4 è una molecola polare a causa della presenza di un doppio legame tra gli atomi di carbonio, che si traduce in una distribuzione asimmetrica della carica e un momento dipolare.
