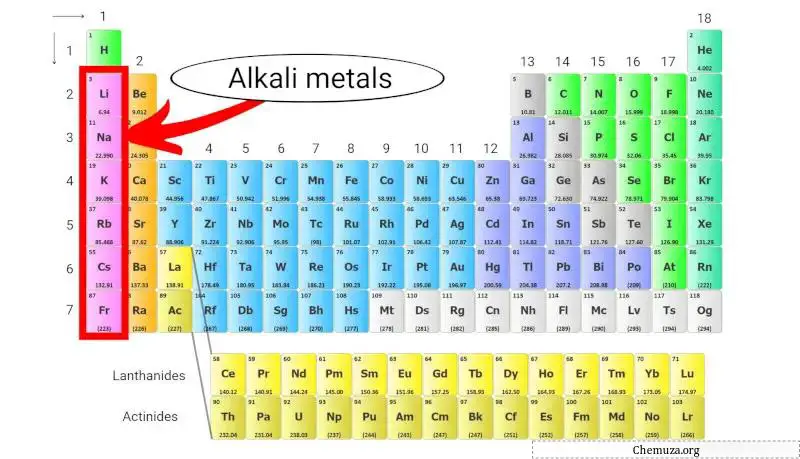
I metalli alcalini sono un gruppo di elementi chimici situati nella prima colonna della tavola periodica . Questo gruppo comprende litio , sodio , potassio , rubidio , cesio e francio .
I metalli alcalini sono teneri e hanno bassi punti di fusione e di ebollizione. Sono comunemente usati in batterie, leghe e varie reazioni chimiche.
Esploriamo di più sui metalli alcalini nella tavola periodica.
Cosa sono i metalli alcalini?

I metalli alcalini sono un gruppo di elementi chimici della tavola periodica che appartengono al gruppo 1 .
Questi elementi sono noti per la loro morbidezza, bassi punti di fusione, elevata reattività e capacità di formare soluzioni alcaline quando reagiscono con l’acqua.
Alcune delle proprietà chiave dei metalli alcalini includono:
- Hanno bassa elettronegatività ed energia di ionizzazione, il che significa che tendono a perdere facilmente elettroni e formare cationi.
- Hanno bassi punti di fusione e di ebollizione, che li rendono relativamente morbidi e facili da sciogliere.
- Hanno un’elevata reattività con l’acqua e l’ossigeno, rendendoli reattivi nell’aria e nell’acqua.
- Sono buoni conduttori di calore ed elettricità.
Perché i metalli alcalini si chiamano così?

I metalli alcalini sono così chiamati perché sono in grado di formare soluzioni fortemente alcaline (basiche) quando reagiscono con l’acqua. [1]
Quando questi metalli entrano in contatto con l’acqua, rilasciano idrogeno gassoso e formano ioni idrossido, che conferiscono alla soluzione un pH basico .
Spiegazione:
La reattività dei metalli alcalini con l’acqua è dovuta alla loro bassa energia di ionizzazione [2] , il che significa che sono in grado di perdere facilmente elettroni e formare ioni positivi (cationi).
Quando entrano in contatto con l’acqua, subiscono una reazione chimica in cui perdono elettroni e reagiscono con le molecole d’acqua per formare ioni idrossido e gas idrogeno.
Questa reazione rilascia molto calore, che può causare l’accensione e l’esplosione del gas idrogeno.
Ordine di reattività dei metalli alcalini
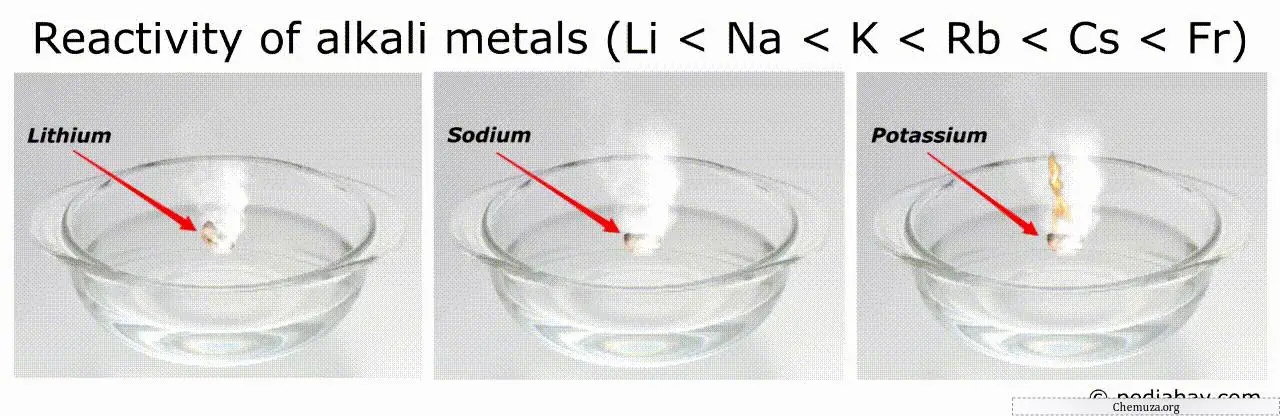
La tendenza generale nell’ordine di reattività dei metalli alcalini è che esso aumenta man mano che si scende nel gruppo dal litio (Li) al francio (Fr).
Ciò significa che il francio è il più reattivo tra tutti i metalli alcalini, mentre il litio è il meno reattivo.
La ragione di questa tendenza è che man mano che si scende nel gruppo, il raggio atomico degli elementi aumenta, mentre l’energia di ionizzazione diminuisce.
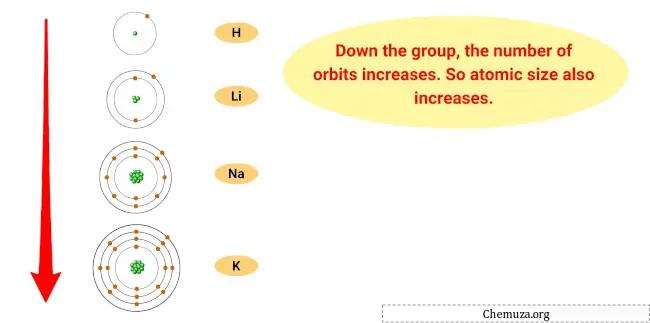
Ciò significa che l’elettrone più esterno degli atomi è più lontano dal nucleo e trattenuto meno strettamente, rendendo più facile per l’elemento perdere quell’elettrone e diventare un catione.
Il Francio, essendo il più grande e il meno strettamente correlato del gruppo, è quindi il più reattivo.
Questo ordine di reattività ha importanti implicazioni per le proprietà e il comportamento dei metalli alcalini.
Ad esempio, i metalli più reattivi (come il francio e il cesio) possono accendersi spontaneamente nell’aria o nell’acqua, rendendoli molto pericolosi da maneggiare.[3]
Al contrario, i metalli meno reattivi (come il litio) sono più stabili e possono essere utilizzati in applicazioni che richiedono un metallo più stabile.
Elenco dei metalli alcalini e loro configurazioni elettroniche
Di seguito sono mostrati i metalli alcalini e le loro configurazioni elettroniche.
| Elemento | Configurazione elettronica |
| Litio (Li) | [It] 2s 1 |
| Sodio (Na) | [Fai] 3 secondi 1 |
| Potassio (K) | [Ar] 4s 1 |
| Rubidio (Rb) | [Kr] 5s 1 |
| Cesio (Cs) | [Xe] 6s 1 |
| Francio (Fr) | [Rn] 7s 1 |
Tendenze periodiche dei metalli alcalini
Gli andamenti periodici dei metalli alcalini sono menzionati di seguito:
- Tendenza della valenza: la valenza dei metalli alcalini è sempre +1, il che significa che tendono a perdere un elettrone per formare un catione stabile. Non vi è quindi alcun cambiamento nella valenza dei metalli alcalini man mano che si scende nel gruppo. Hanno tutti la stessa valenza (cioè 1).
- Andamento delle dimensioni atomiche: la dimensione atomica dei metalli alcalini aumenta man mano che si scende nel gruppo, il che significa che gli atomi diventano più grandi. Questo perché man mano che si aggiungono livelli di energia, la dimensione della nuvola di elettroni aumenta.
- Tendenza del carattere metallico: il carattere metallico dei metalli alcalini aumenta man mano che si scende nel gruppo. Questo perché i metalli diventano più elettropositivi e sono più capaci di donare elettroni per formare legami metallici.
- Tendenza dell’elettronegatività: l’elettronegatività dei metalli alcalini diminuisce man mano che si scende nel gruppo. Questo perché gli atomi diventano più grandi e gli elettroni esterni sono più lontani dal nucleo, quindi ne sono meno attratti.
- Tendenza dell’affinità elettronica: l’affinità elettronica dei metalli alcalini diminuisce man mano che si scende nel gruppo. Infatti, nella parte inferiore del gruppo, la dimensione degli atomi aumenta, il che diminuisce la tendenza di un atomo ad accettare l’elettrone. (Leggi ulteriori informazioni sull’andamento dell’affinità elettronica qui, per una comprensione dettagliata).
- Tendenza dell’energia di ionizzazione: l’energia di ionizzazione dei metalli alcalini diminuisce man mano che si scende nel gruppo. Ciò significa che è più facile rimuovere un elettrone dal guscio più esterno dell’atomo, perché gli elettroni sono più lontani dal nucleo e sono trattenuti meno strettamente.
Riepilogo
I metalli alcalini sono un gruppo di elementi chimici noti per la loro morbidezza, basso punto di fusione, elevata reattività e capacità di formare soluzioni alcaline quando reagiscono con l’acqua.
L’ordine di reattività dei metalli alcalini aumenta man mano che si scende nel gruppo dal litio al francio a causa dell’aumento del raggio atomico e della diminuzione dell’energia di ionizzazione.
Le tendenze periodiche dei metalli alcalini includono un aumento della dimensione atomica e del carattere metallico man mano che si scende nel gruppo, nonché una diminuzione dell’elettronegatività, dell’affinità elettronica e dell’energia di ionizzazione.
La valenza dei metalli alcalini è sempre +1 e le loro configurazioni elettroniche seguono un modello [gas nobili] ns 1 .
