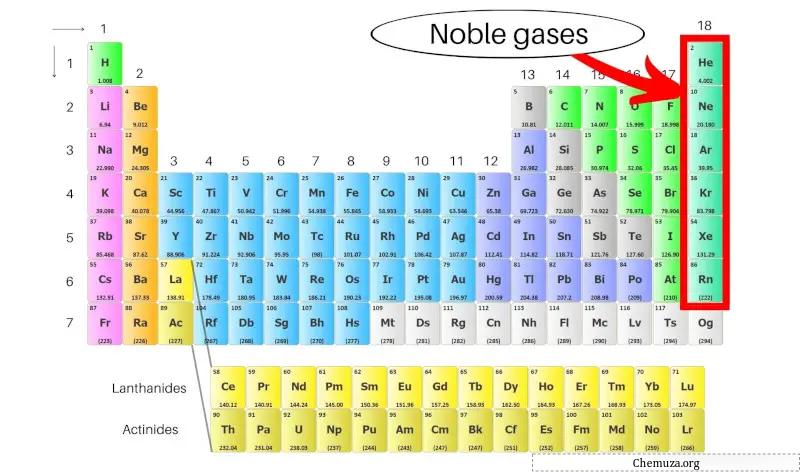
I gas nobili, detti anche gas inerti, sono un gruppo di elementi situati nella colonna più a destra della tavola periodica . Includono l’elio (He), il neon (Ne), l’argon (Ar), il kripton (Kr), lo xeno (Xe) e il radon (Rn).
Questi elementi sono noti per la loro bassa reattività dovuta ai loro gusci elettronici completi più esterni, che li rendono stabili e non reattivi con altri elementi. [1]
Esploriamo altri gas nobili nella tavola periodica.
Cosa sono i gas nobili?
I gas nobili sono elementi del Gruppo 18 che si caratterizzano per la loro bassissima reattività con altre sostanze, il che significa che generalmente non formano composti con altri elementi.
Sono chiamati anche gas inerti perché sono molto stabili e non reagiscono facilmente con altre sostanze. I gas nobili includono elio, neon, argon, kripton, xeno e radon.
I gas nobili si trovano in piccole quantità nell’atmosfera terrestre e vengono utilizzati in una varietà di applicazioni, come l’illuminazione, la saldatura e la criogenia. [2]
Perché i gas nobili sono inerti?
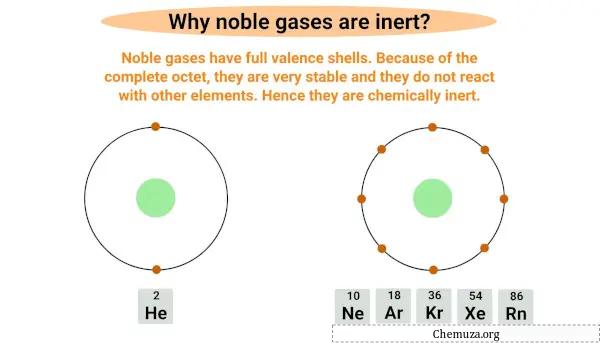
I gas nobili sono inerti o non reattivi perché hanno un guscio elettronico più esterno completo, noto anche come guscio di valenza .
Il guscio di valenza è il guscio più esterno di elettroni che circonda un atomo e contiene i suoi elettroni di valenza , che sono gli elettroni coinvolti nelle reazioni chimiche.
I gas nobili sono un ottetto completo, nel senso che hanno un guscio di valenza completo con otto elettroni, ad eccezione dell’elio che ha solo due elettroni nel suo guscio più esterno.
Avere un byte pieno li rende molto stabili e difficilmente reagiscono con altri elementi.
Nelle reazioni chimiche, gli elementi tendono a guadagnare o perdere elettroni per acquisire un intero ottetto nel loro guscio di valenza, ma poiché i gas nobili hanno già un guscio di valenza completo, non hanno bisogno di guadagnare o perdere elettroni.
Questa configurazione stabile dei gas rari è dovuta alla loro configurazione elettronica.
Il guscio elettronico più esterno di questi elementi è pieno e quindi non hanno bisogno di guadagnare o perdere elettroni.
Ciò significa che sono molto poco reattivi e non tendono a formare legami chimici con altri elementi.
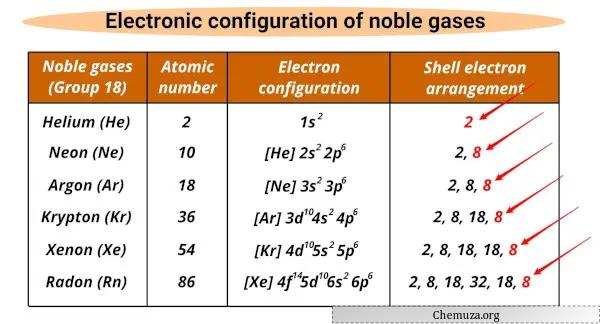
Elenco dei gas nobili e loro configurazioni elettroniche
Di seguito sono riportati i gas nobili e le loro configurazioni elettroniche.
Cosa hanno in comune tutti i gas nobili?
I gas nobili condividono alcune proprietà comuni .
Hanno tutti lo stesso numero di elettroni di valenza (8), tranne l’elio che ne ha 2.
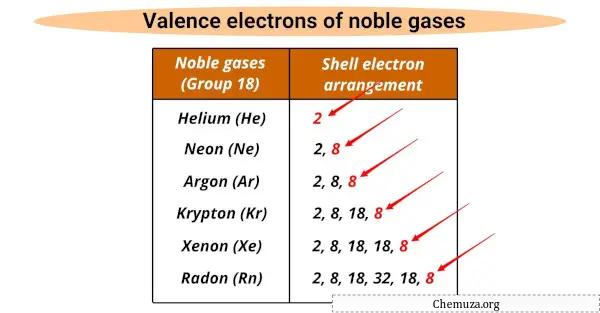
Gli elettroni di valenza sono gli elettroni più esterni di un atomo che partecipano alle reazioni chimiche e i gas nobili hanno un guscio di valenza completo che li rende non reattivi.
Inoltre, i gas nobili sono gas incolori che non possiamo vedere e sono anche inodori , ovvero non hanno odore. [3]
Infine, esistono naturalmente come gas monoatomici , nel senso che hanno un solo atomo nella loro forma elementare.
A differenza della maggior parte degli altri elementi che tendono a formare molecole legandosi ad altri atomi, i gas nobili non hanno bisogno di legarsi ad altri atomi perché hanno un guscio di valenza completo, che li rende molto stabili e non reattivi.
Riepilogo
I gas nobili sono un gruppo di elementi che si trovano nella colonna più a destra della tavola periodica, tra cui elio, neon, argon, kripton, xeno e radon.
Sono caratterizzati da una bassa reattività dovuta ai loro strati elettronici interamente esterni. I gas nobili sono inerti o non reattivi perché hanno un guscio a valenza completa, che li rende molto stabili e difficilmente reagiscono con altri elementi.
I gas nobili condividono proprietà comuni, incluso lo stesso numero di elettroni di valenza (8 tranne l’elio che ne ha 2), un gas incolore e inodore, ed esistono naturalmente come gas monoatomici.
Sono utilizzati in varie applicazioni come illuminazione, saldatura e criogenia, nonché come refrigeranti nei reattori nucleari e come riempitivi per lampadine a incandescenza.
