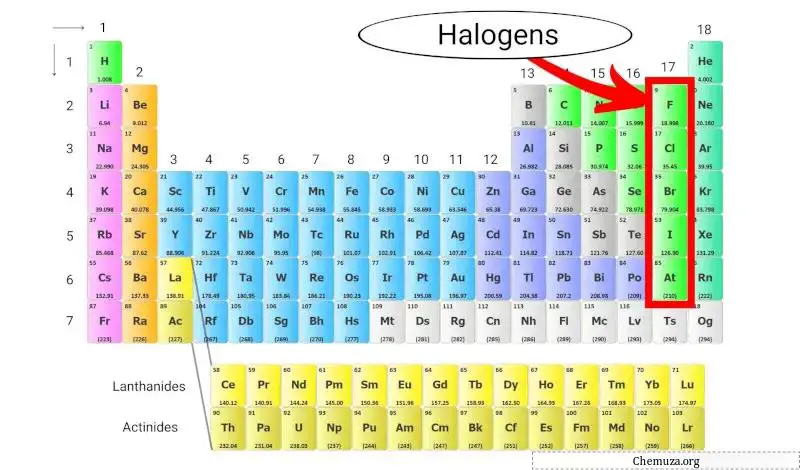
Gli alogeni sono un gruppo di elementi che si trovano nel gruppo 17 (chiamato anche gruppo alogeno) della tavola periodica . Gli alogeni comprendono cinque diversi elementi: fluoro (F), cloro (Cl), bromo (Br), iodio (I) e astato (At).
Gli alogeni sono unici perché sono l’unico gruppo di elementi in grado di formare composti con tutti gli altri elementi della tavola periodica.
Esploriamo ulteriormente gli alogeni.
Cosa sono gli alogeni? E perché si chiamano così?
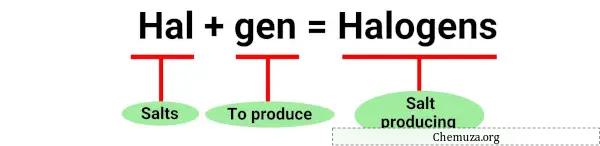
Il termine “alogeno” deriva dalle parole greche “halos” che significa sale e “geni” che significa produttore. [1]
In effetti, gli alogeni furono scoperti per la prima volta grazie alla loro capacità di produrre sali quando reagiscono con i metalli .
Per esempio:
Quando il cloro (Cl 2 ) reagisce con il sodio (Na), forma cloruro di sodio (NaCl), che è un comune sale da cucina:
2Na + Cl2 → 2NaCl
Allo stesso modo, quando il bromo (Br 2 ) reagisce con il potassio (K), forma bromuro di potassio (KBr):
2K + Br2 → 2KBr
Queste reazioni sono esempi di alogeni che producono sali quando reagiscono con i metalli, da qui il nome “alogeno”.
L’alogeno più reattivo della tavola periodica
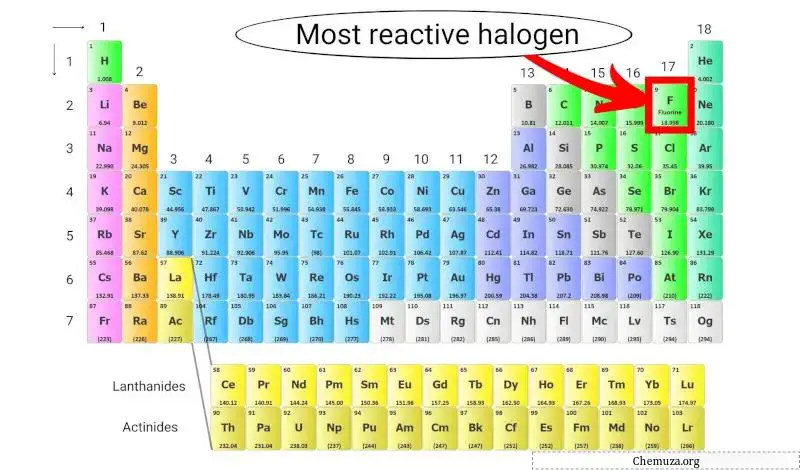
Il fluoro è l’alogeno più reattivo perché ha l’elettronegatività più alta di tutti gli elementi della tavola periodica, il che significa che ha una forte attrazione per gli elettroni.
Ciò lo rende molto reattivo e capace di reagire con quasi tutti gli altri elementi della tavola periodica per formare composti. [2]
In poche parole, il fluoro è come un magnete per gli elettroni e farà tutto il possibile per acquisire un elettrone e completare il suo guscio esterno.
Lo fa reagendo con altri elementi e rubando i loro elettroni per formare nuovi composti.
Questo è il motivo per cui il fluoro è così reattivo e non si trova mai nella sua forma elementare in natura, ma esiste sempre come composto.
A causa della sua elevata reattività, il fluoro è anche estremamente pericoloso e può essere pericoloso da usare.
Viene spesso gestito in laboratori specializzati e viene utilizzato nei processi industriali per produrre un’ampia gamma di prodotti chimici e materiali.
Reattività degli alogeni
Gli alogeni sono molto reattivi a causa della loro maggiore elettronegatività, il che significa che hanno un’elevata capacità di attrarre gli elettroni.
Inoltre, gli alogeni hanno 7 elettroni nel loro guscio più esterno e hanno bisogno solo di un elettrone in più per riempirlo e raggiungere una configurazione elettronica stabile come i gas nobili .
Ad esempio, puoi vedere che il diagramma di Bohr per il fluoro ha 7 elettroni nel suo guscio più esterno.
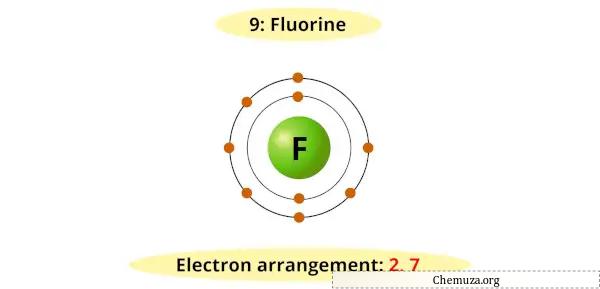
Ora è necessario 1 elettrone in più per ottenere un ottetto stabile (7 + 1 = 8).
Gli alogeni reagiscono con i metalli per formare composti ionici chiamati alogenuri metallici , che possono produrre fiamme luminose e colorate.
Reagiscono anche con non metalli come idrogeno , zolfo e azoto per formare una serie di composti covalenti. [3]
Pertanto, la tendenza degli alogeni ad acquisire un elettrone e ad ottenere una configurazione stabile di gas nobile li rende molto reattivi e capaci di formare composti con altri elementi.
Tendenze periodiche degli alogeni
Man mano che scendiamo nel gruppo, gli elementi alogeni mostrano cambiamenti nelle loro proprietà fisiche e chimiche.
Diamo un’occhiata alle tendenze in alcune proprietà degli alogeni.
- Dimensione atomica: man mano che si scende nel gruppo, la dimensione atomica degli alogeni aumenta. Questo perché ogni alogeno ha un livello energetico in più rispetto a quello superiore, il che significa che gli elettroni più esterni sono più lontani dal nucleo.
- Elettronegatività: man mano che si scende nel gruppo, l’elettronegatività degli elementi alogeni diminuisce. Ciò significa che gli alogeni nella parte superiore del gruppo, come il fluoro e il cloro, sono più elettronegativi e quindi hanno maggiori probabilità di attrarre elettroni rispetto a quelli nella parte inferiore, come iodio e astato.
- Punti di fusione e punti di ebollizione: man mano che si scende nel gruppo, i punti di fusione e di ebollizione degli alogeni aumentano. Infatti, gli atomi più grandi hanno più elettroni e sono in grado di formare forze intermolecolari più forti. [4]
- Reattività verso i metalli: man mano che si scende nel gruppo, la reattività degli alogeni verso i metalli diminuisce. Ciò significa che gli alogeni in cima al gruppo, come il fluoro e il cloro, hanno maggiori probabilità di reagire con i metalli rispetto a quelli in fondo, come lo iodio e l’astato.
Riepilogo
Gli alogeni sono un gruppo di cinque elementi (fluoro, cloro, bromo, iodio e astato) presenti nel gruppo 17 della tavola periodica. Sono unici nella loro capacità di formare composti con tutti gli altri elementi.
Gli alogeni sono molto reattivi a causa della loro elevata elettronegatività e della tendenza ad acquisire un elettrone per ottenere una configurazione stabile di gas nobile. Il fluoro è l’alogeno più reattivo a causa della sua elevata elettronegatività.
Man mano che si scende nel gruppo, gli alogeni mostrano cambiamenti nelle loro proprietà fisiche e chimiche, come un aumento delle dimensioni atomiche, una diminuzione dell’elettronegatività e un aumento dei punti di fusione e di ebollizione. Anche la reattività degli alogeni verso i metalli diminuisce man mano che si scende nel gruppo.
