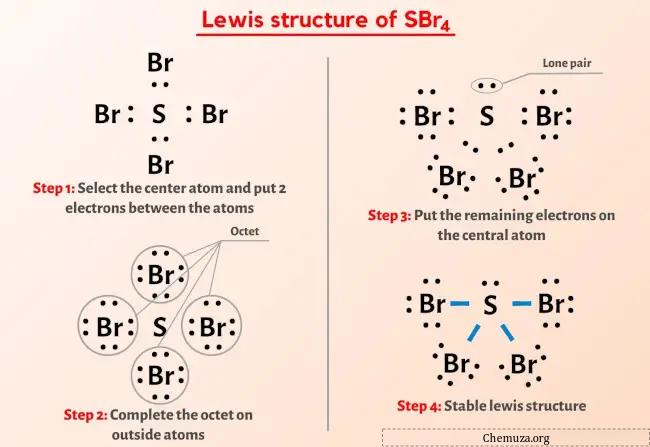
Quindi hai già visto l’immagine qui sopra, giusto?
Lasciatemi spiegare brevemente l’immagine sopra.
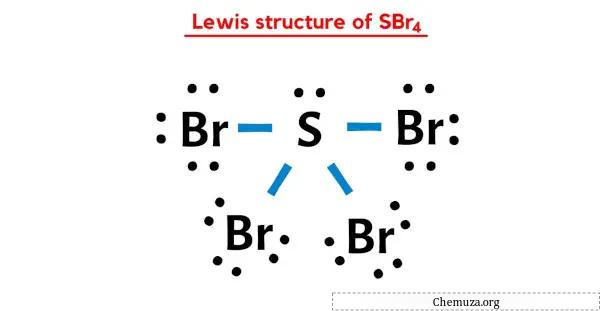
La struttura di Lewis SBr4 ha un atomo di zolfo (S) al centro circondato da quattro atomi di bromo (Br). Ci sono 4 legami singoli tra l’atomo di zolfo (S) e ciascun atomo di bromo (Br). C’è 1 coppia solitaria sull’atomo di zolfo (S) e 3 coppie solitarie sui quattro atomi di bromo (Br).
Se non hai capito nulla dall’immagine sopra della struttura di Lewis di SBr4, resta con me e otterrai la spiegazione dettagliata passo passo su come disegnare una struttura di Lewis di SBr4.
Passiamo quindi ai passaggi per disegnare la struttura di Lewis di SBr4.
Passi per disegnare la struttura di Lewis di SBr4
Passaggio 1: trovare il numero totale di elettroni di valenza nella molecola SBr4
Per trovare il numero totale di elettroni di valenza nella molecola SBr4 , devi prima conoscere gli elettroni di valenza presenti nell’atomo di zolfo e nell’atomo di bromo.
(Gli elettroni di valenza sono gli elettroni presenti nell’orbita più esterna di qualsiasi atomo.)
Qui ti dirò come trovare facilmente gli elettroni di valenza dello zolfo e del bromo utilizzando una tavola periodica.
Elettroni di valenza totali nella molecola SBr4
→ Elettroni di valenza dati dall’atomo di zolfo:
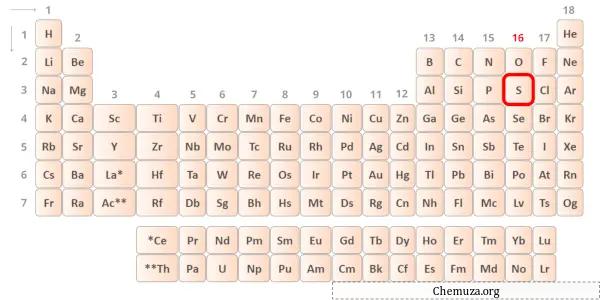
Lo zolfo è un elemento del gruppo 16 della tavola periodica. [1] Pertanto gli elettroni di valenza presenti nello zolfo sono 6 .
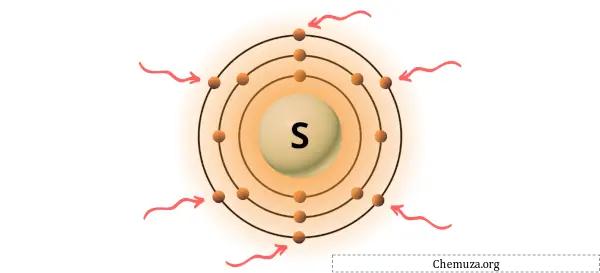
Puoi vedere i 6 elettroni di valenza presenti nell’atomo di zolfo, come mostrato nell’immagine sopra.
→ Elettroni di valenza dati dall’atomo di bromo:
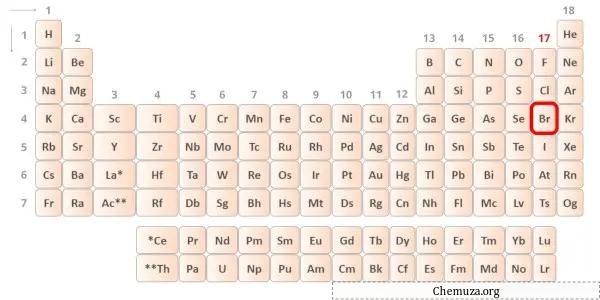
Il bromo è un elemento del gruppo 17 della tavola periodica. [2] Pertanto, gli elettroni di valenza presenti nel bromo sono 7 .
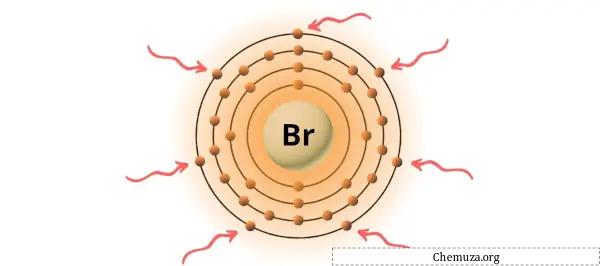
Puoi vedere i 7 elettroni di valenza presenti nell’atomo di bromo, come mostrato nell’immagine sopra.
COSÌ,
Elettroni di valenza totali nella molecola SBr4 = elettroni di valenza donati da 1 atomo di zolfo + elettroni di valenza donati da 4 atomi di bromo = 6 + 7(4) = 34 .
Passaggio 2: seleziona l’atomo centrale
Per selezionare l’atomo centrale dobbiamo ricordare che al centro rimane l’atomo meno elettronegativo .
Ora qui la molecola data è SBr4 e contiene atomi di zolfo (S) e atomi di bromo (Br).
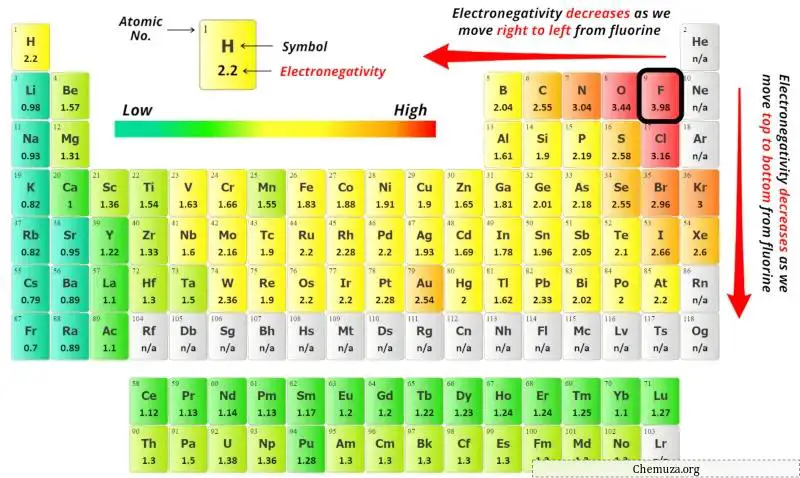
Puoi vedere i valori di elettronegatività dell’atomo di zolfo (S) e dell’atomo di bromo (Br) nella tavola periodica qui sopra.
Se confrontiamo i valori di elettronegatività dello zolfo (S) e del bromo (Br), allora l’ atomo di zolfo è meno elettronegativo .
Qui, l’atomo di zolfo (S) è l’atomo centrale e gli atomi di bromo (Br) sono gli atomi esterni.
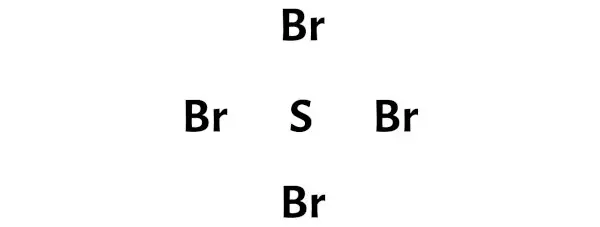
Passaggio 3: collega ciascun atomo posizionando una coppia di elettroni tra di loro
Ora, nella molecola SBr4, è necessario inserire le coppie di elettroni tra l’atomo di zolfo (S) e gli atomi di bromo (Br).
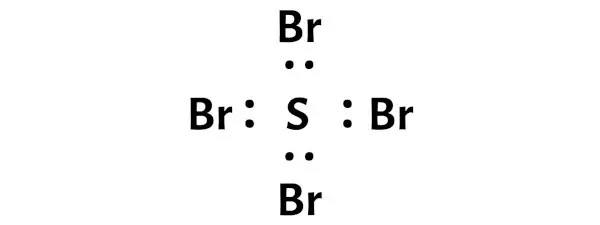
Ciò indica che lo zolfo (S) e il bromo (Br) sono legati chimicamente tra loro in una molecola SBr4.
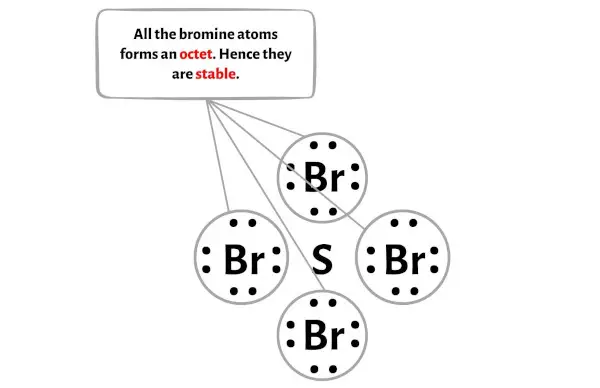
Passaggio 4: rendere stabili gli atomi esterni
In questo passaggio è necessario verificare la stabilità degli atomi esterni.
Qui nello schizzo della molecola SBr4 puoi vedere che gli atomi esterni sono atomi di bromo.
Questi atomi di bromo esterni formano un ottetto e sono quindi stabili.
Inoltre, nel passaggio 1, abbiamo calcolato il numero totale di elettroni di valenza presenti nella molecola SBr4.
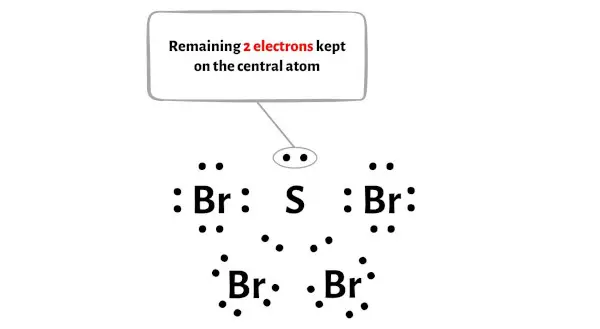
La molecola SBr4 ha un totale di 34 elettroni di valenza e di questi, solo 32 elettroni di valenza vengono utilizzati nel diagramma sopra.
Quindi il numero di elettroni rimanenti = 34 – 32 = 2 .
È necessario posizionare questi 2 elettroni sull’atomo di zolfo centrale nel diagramma sopra della molecola SBr4.
Ora passiamo al passaggio successivo.
Passaggio 5: verificare la stabilità della struttura di Lewis
Ora sei arrivato all’ultimo passaggio in cui devi verificare la stabilità della struttura di Lewis di SBr4.
La stabilità della struttura di Lewis può essere verificata utilizzando un concetto formale di carica .
In breve, dobbiamo ora trovare la carica formale sugli atomi di zolfo (S) e di bromo (Br) presenti nella molecola SBr4.
Per calcolare l’imposta formale, è necessario utilizzare la seguente formula:
Carica formale = Elettroni di valenza – (Elettroni di legame)/2 – Elettroni non di legame
Puoi vedere il numero di elettroni di legame e di elettroni non di legame per ciascun atomo della molecola SBr4 nell’immagine qui sotto.
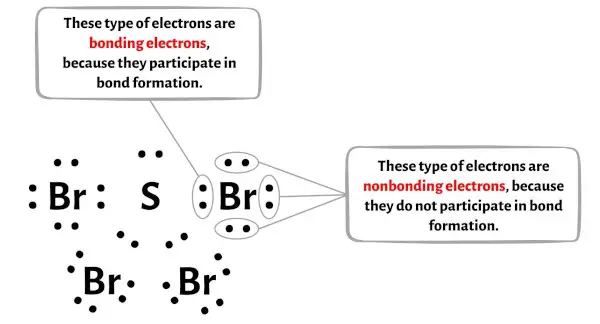
Per l’atomo di Zolfo (S):
Elettroni di valenza = 6 (perché lo zolfo è nel gruppo 16)
Elettroni di legame = 8
Elettroni non leganti = 2
Per l’atomo di bromo (Br):
Elettrone di valenza = 7 (perché il bromo è nel gruppo 17)
Elettroni di legame = 2
Elettroni non leganti = 6
| Accusa formale | = | elettroni di valenza | – | (Elettroni leganti)/2 | – | Elettroni non leganti | ||
| S | = | 6 | – | 8/2 | – | 2 | = | 0 |
| Fratello | = | 7 | – | 2/2 | – | 6 | = | 0 |
Dai calcoli sulla carica formale di cui sopra, puoi vedere che l’atomo di zolfo (S) così come l’atomo di bromo (Br) hanno carica formale “zero” .
Ciò indica che la struttura di Lewis di SBr4 di cui sopra è stabile e non vi sono ulteriori cambiamenti nella struttura di SBr4 di cui sopra.
Nella struttura a punti di Lewis di SBr4 sopra, puoi anche rappresentare ciascuna coppia di elettroni di legame (:) come un singolo legame (|). Ciò si tradurrà nella seguente struttura di Lewis di SBr4.
Spero che tu abbia compreso completamente tutti i passaggi precedenti.
Per fare più pratica e comprendere meglio, puoi provare altre strutture di Lewis elencate di seguito.
Prova (o almeno vedi) queste strutture di Lewis per una migliore comprensione:
