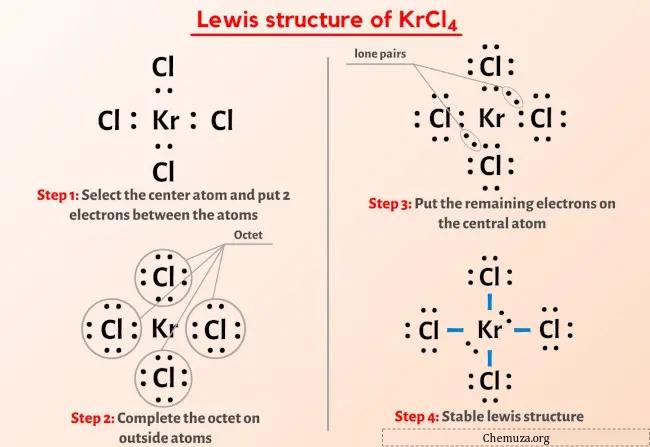
Quindi hai già visto l’immagine qui sopra, giusto?
Lasciatemi spiegare brevemente l’immagine sopra.
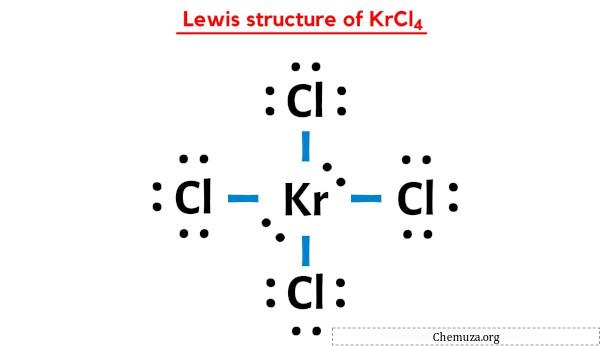
La struttura di Lewis KrCl4 ha un atomo di Krypton (Kr) al centro circondato da quattro atomi di cloro (Cl). Ci sono 4 legami singoli tra l’atomo di Krypton (Kr) e ciascun atomo di cloro (Cl). Ci sono 2 coppie solitarie sull’atomo di Krypton (Kr) e 3 coppie solitarie sui quattro atomi di cloro (Cl).
Se non hai capito nulla dall’immagine sopra della struttura di Lewis di KrCl4, resta con me e otterrai la spiegazione dettagliata passo passo su come disegnare una struttura di Lewis di KrCl4.
Passiamo quindi ai passaggi per disegnare la struttura di Lewis di KrCl4.
Passaggi per disegnare la struttura di Lewis KrCl4
Passaggio 1: trovare il numero totale di elettroni di valenza nella molecola KrCl4
Per trovare il numero totale di elettroni di valenza in una molecola di KrCl4, devi prima conoscere gli elettroni di valenza presenti nell’atomo di kripton e nell’atomo di cloro.
(Gli elettroni di valenza sono gli elettroni presenti nell’orbita più esterna di qualsiasi atomo.)
Qui spiegherò come trovare facilmente gli elettroni di valenza del kripton e del cloro utilizzando una tavola periodica.
Elettroni di valenza totali nella molecola KrCl4
→ Elettroni di valenza dati dall’atomo di kripton:
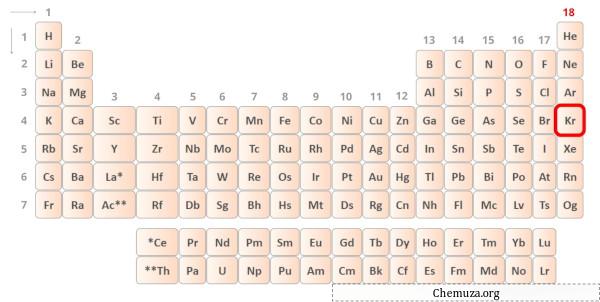
Krypton è un elemento nel gruppo 18 della tavola periodica.[1] Pertanto, gli elettroni di valenza presenti nel kripton sono 8 .
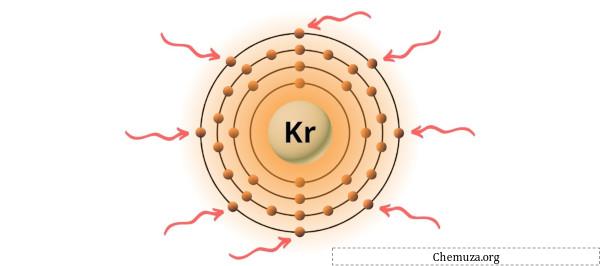
Puoi vedere gli 8 elettroni di valenza presenti nell’atomo di kripton, come mostrato nell’immagine sopra.
→ Elettroni di valenza dati dall’atomo di cloro:

Il cloro è un elemento del gruppo 17 della tavola periodica. [2] Pertanto gli elettroni di valenza presenti nel cloro sono 7 .
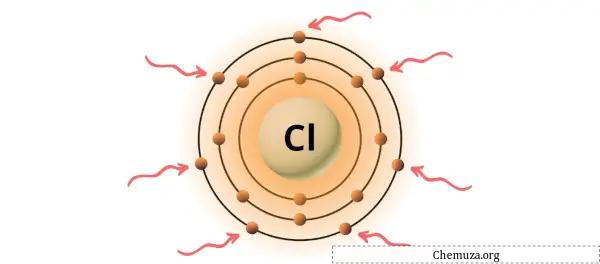
Puoi vedere i 7 elettroni di valenza presenti nell’atomo di cloro come mostrato nell’immagine sopra.
COSÌ,
Elettroni di valenza totali nella molecola di KrCl4 = elettroni di valenza donati da 1 atomo di kripton + elettroni di valenza donati da 4 atomi di cloro = 8 + 7(4) = 36 .
Passaggio 2: seleziona l’atomo centrale
Per selezionare l’atomo centrale dobbiamo ricordare che al centro rimane l’atomo meno elettronegativo .
Ora qui la molecola data è KrCl4 e contiene atomi di kripton (Kr) e atomi di cloro (Cl).
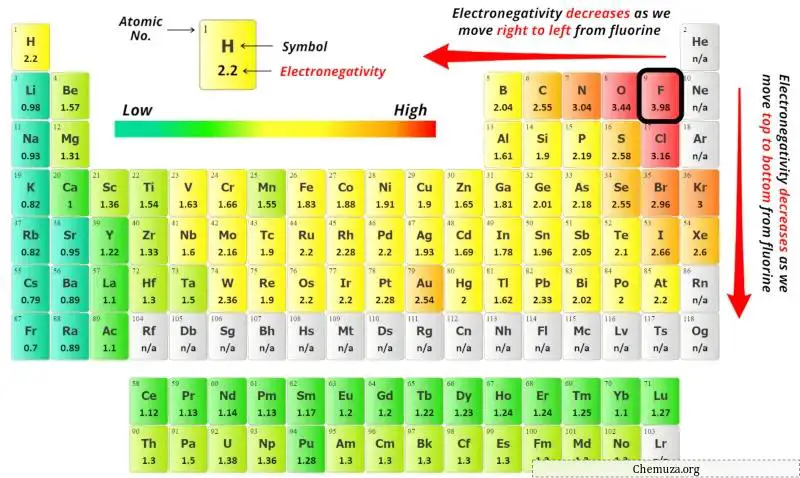
Puoi vedere i valori di elettronegatività dell’atomo di kripton (Kr) e dell’atomo di cloro (Cl) nella tavola periodica qui sopra.
Se confrontiamo i valori di elettronegatività di krypton (Kr) e cloro (Cl), allora l’ atomo di krypton è meno elettronegativo .
Qui, l’atomo di kripton (Kr) è l’atomo centrale e gli atomi di cloro (Cl) sono gli atomi esterni.
Passaggio 3: collega ciascun atomo posizionando una coppia di elettroni tra di loro
Ora nella molecola KrCl4, dobbiamo mettere le coppie di elettroni tra l’atomo di kripton (Kr) e gli atomi di cloro (Cl).
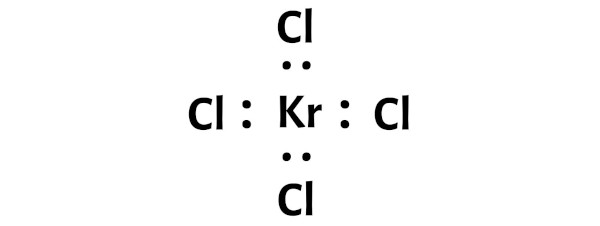
Ciò indica che il kripton (Kr) e il cloro (Cl) sono legati chimicamente tra loro in una molecola KrCl4.
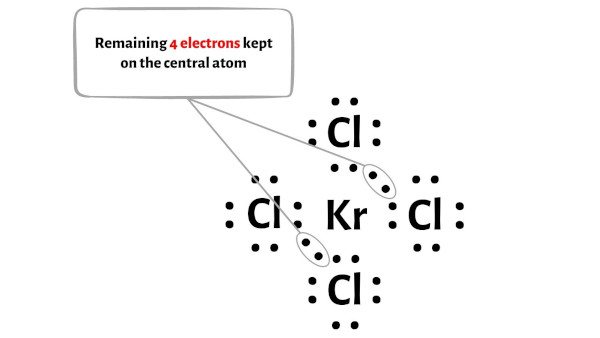
Passaggio 4: rendere stabili gli atomi esterni. Posiziona la coppia di elettroni di valenza rimanente sull’atomo centrale.
In questo passaggio è necessario verificare la stabilità degli atomi esterni.
Qui nello schizzo della molecola KrCl4 puoi vedere che gli atomi esterni sono atomi di cloro.
Questi atomi di cloro esterni formano un ottetto e sono quindi stabili.
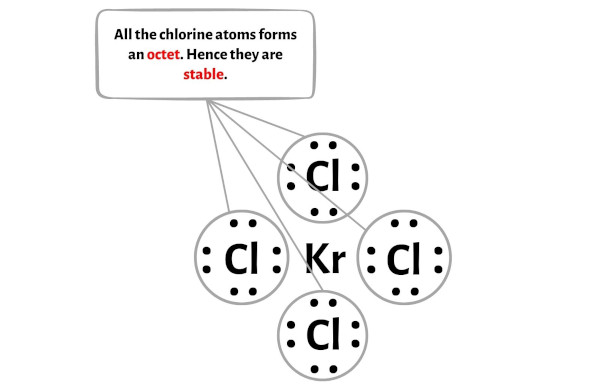
Inoltre, nel passaggio 1, abbiamo calcolato il numero totale di elettroni di valenza presenti nella molecola KrCl4.
La molecola KrCl4 ha un totale di 36 elettroni di valenza e di questi, solo 32 elettroni di valenza vengono utilizzati nel diagramma sopra.
Quindi il numero di elettroni rimanenti = 36 – 32 = 4 .
È necessario posizionare questi 4 elettroni sull’atomo centrale di kripton nel diagramma sopra della molecola KrCl4.
Ora passiamo al passaggio successivo.
Passaggio 5: verificare la stabilità della struttura di Lewis
Ora sei arrivato all’ultimo passaggio in cui devi verificare la stabilità della struttura di Lewis di KrCl4.
La stabilità della struttura di Lewis può essere verificata utilizzando un concetto formale di carica .
In breve, ora dobbiamo trovare la carica formale degli atomi di kripton (Kr) e di cloro (Cl) presenti nella molecola KrCl4.
Per calcolare l’imposta formale, è necessario utilizzare la seguente formula:
Carica formale = Elettroni di valenza – (Elettroni di legame)/2 – Elettroni non di legame
Puoi vedere il numero di elettroni di legame e di elettroni non di legame per ciascun atomo della molecola KrCl4 nell’immagine qui sotto.
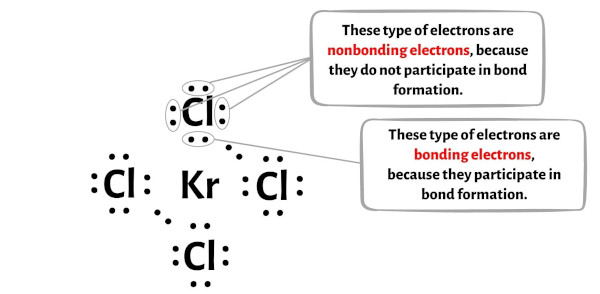
Per l’atomo di Krypton (Kr):
Elettroni di valenza = 8 (perché krypton è nel gruppo 18)
Elettroni di legame = 8
Elettroni non leganti = 4
Per l’atomo di cloro (Cl):
Valenza elettronica = 7 (perché il cloro è nel gruppo 17)
Elettroni di legame = 2
Elettroni non leganti = 6
| Accusa formale | = | elettroni di valenza | – | (Elettroni leganti)/2 | – | Elettroni non leganti | ||
| Kr | = | 8 | – | 8/2 | – | 4 | = | 0 |
| Cl | = | 7 | – | 2/2 | – | 6 | = | 0 |
Dai calcoli sulla carica formale di cui sopra, puoi vedere che l’atomo di kripton (Kr) così come l’atomo di cloro (Cl) hanno carica formale “zero” .
Ciò indica che la struttura di Lewis di KrCl4 di cui sopra è stabile e non vi sono ulteriori cambiamenti nella struttura di KrCl4 di cui sopra.
Nella struttura a punti di Lewis di KrCl4 sopra, puoi anche rappresentare ciascuna coppia di elettroni di legame (:) come un singolo legame (|). In questo modo si otterrà la seguente struttura di Lewis di KrCl4.
Spero che tu abbia compreso completamente tutti i passaggi precedenti.
Per fare più pratica e comprendere meglio, puoi provare altre strutture di Lewis elencate di seguito.
Prova (o almeno vedi) queste strutture di Lewis per una migliore comprensione:
