Il solfuro di zinco (ZnS) è un composto composto da zinco e zolfo. Viene utilizzato in varie applicazioni tra cui materiali luminescenti, optoelettronica e fosfori per display a LED.
| Nome IUPAC | Solfuro di zinco |
| Formula molecolare | ZnS |
| numero CAS | 1314-98-3 |
| Sinonimi | Sfalerite, Blende, Blende di Zinco, Wurtzite |
| InChI | InChI=1S/S.Zn |
Proprietà del solfuro di zinco
Formula di solfuro di zinco
La formula chimica del solfuro di zinco è ZnS, che indica la sua composizione di atomi di zinco (Zn) e zolfo (S). Questo composto costituisce una parte cruciale di varie applicazioni industriali e scientifiche grazie alle sue proprietà uniche.
Massa molare del solfuro di zinco
Il solfuro di zinco ha una massa molare di circa 97,45 grammi per mole. Questo valore rappresenta le masse atomiche combinate degli atomi di zinco e zolfo costituenti in una singola molecola di ZnS.
Punto di ebollizione del solfuro di zinco
Il solfuro di zinco non ha un punto di ebollizione distinto perché tende a decomporsi piuttosto che subire un vero processo di ebollizione quando riscaldato. Questa caratteristica deriva dalle sue proprietà chimiche.
Punto di fusione del solfuro di zinco
Il solfuro di zinco ha un punto di fusione di circa 1.850 gradi Celsius (3.362 gradi Fahrenheit). Questo elevato punto di fusione lo rende adatto a varie applicazioni ad alta temperatura.
Densità del solfuro di zinco g/mL
La densità del solfuro di zinco varia a seconda della sua forma cristallina. Generalmente la sua densità è compresa tra 3,98 e 4,09 grammi per centimetro cubo (g/cm³). Questo intervallo di densità contribuisce al suo utilizzo nei materiali ottici.
Peso molecolare del solfuro di zinco
Il peso molecolare del solfuro di zinco, calcolato sommando le masse atomiche dei suoi componenti, è di circa 97,45 grammi per mole. Questo valore è fondamentale per determinare la quantità di ZnS in un dato campione.
Struttura del solfuro di zinco
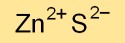
Il solfuro di zinco esiste in diverse strutture cristalline, principalmente come blenda di zinco cubica (nota anche come sfalerite) e wurtzite esagonale. Queste disposizioni di atomi determinano le sue proprietà fisiche e ottiche.
Solubilità del solfuro di zinco
Il solfuro di zinco è scarsamente solubile in acqua, rendendolo praticamente insolubile. Questa caratteristica è dovuta ai forti legami tra gli atomi di zinco e di zolfo, che determinano una limitata dissoluzione in soluzioni acquose. Tuttavia, può essere disciolto in determinati acidi o alcali in condizioni specifiche.
| Aspetto | Solido |
| Peso specifico | 3,98 – 4,09 g/cm³ |
| Colore | Bianco, giallo, marrone, nero |
| Odore | Inodore |
| Massa molare | ~97,45 g/mole |
| Densità | 3,98 – 4,09 g/cm³ |
| Punto di fusione | ~1850°C (~3362°F) |
| Punto di ebollizione | Decomposto |
| Punto flash | Non applicabile |
| solubilità in acqua | Praticamente insolubile |
| Solubilità | Solubile in acidi, alcali in condizioni specifiche |
| Pressione del vapore | Trascurabile |
| Densità del vapore | Non applicabile |
| pKa | ~4.7 |
| pH | ~7 (neutro) |
Sicurezza e pericoli del solfuro di zinco
Il solfuro di zinco ha una bassa tossicità acuta ma può rilasciare anidride solforosa tossica quando riscaldato. È generalmente considerato sicuro in normali condizioni di manipolazione. Tuttavia, l’inalazione delle sue polveri o vapori può causare irritazione respiratoria. Evitare il contatto con la pelle e gli occhi. In caso di esposizione sciacquare abbondantemente e consultare un medico se l’irritazione persiste. Il fuoco o il calore eccessivo possono causare decomposizione e rilasciare gas pericolosi. Conservare lontano da materiali incompatibili. Maneggiare con cura, indossare dispositivi di protezione adeguati e lavorare in aree ben ventilate per garantire la sicurezza e prevenire potenziali rischi associati al solfuro di zinco.
| Simboli di pericolo | Nessuno |
| Descrizione della sicurezza | Bassa tossicità acuta; rilascia gas tossico di anidride solforosa quando riscaldato; maneggiare con cura |
| Numeri di identificazione delle Nazioni Unite | Non applicabile |
| Codice SA | 2830.90.10 |
| Classe di pericolo | Non classificato come pericoloso |
| Gruppo di imballaggio | Non applicabile |
| Tossicità | Bassa tossicità; irritazione respiratoria da polveri o fumi; maneggiare con cura |
Metodi di sintesi del solfuro di zinco
Il solfuro di zinco può essere sintetizzato con vari metodi. Un approccio comune consiste nel far reagire i gas di ossido di zinco (ZnO) e idrogeno solforato (H2S) a temperature elevate. La reazione procede come segue:
ZnO (s) + H2S (g) → ZnS (s) + H2O (g)
Un altro metodo prevede la reazione tra cloruro di zinco (ZnCl2) e gas di idrogeno solforato:
ZnCl2 (aq) + H2S (g) → ZnS (s) + 2 HCl (g)
In alternativa, le nanoparticelle di solfuro di zinco possono essere sintetizzate utilizzando metodi di precipitazione. Ciò comporta la miscelazione di sali di zinco solubili con sali di solfuro solubili in condizioni controllate, portando alla formazione di nanoparticelle di solfuro di zinco. In alcuni casi, i composti organici vengono utilizzati come agenti di copertura per controllare la dimensione e la stabilità delle particelle.
Il solfuro di zinco può anche essere preparato facendo reagire lo zinco metallico con lo zolfo elementare. Le due sostanze vengono riscaldate insieme per avviare la reazione:
Zn(s) + S(s) → ZnS(s)
Questi metodi forniscono versatilità nella produzione di solfuro di zinco con proprietà diverse per diverse applicazioni, come optoelettronica, materiali luminescenti, ecc.
Usi del solfuro di zinco
Il solfuro di zinco trova varie applicazioni in vari settori grazie alle sue proprietà uniche. Ecco i suoi usi notevoli:
- Rivestimenti ottici: la trasparenza del solfuro di zinco nella regione degli infrarossi lo rende un materiale prezioso per rivestimenti ottici, lenti e finestre nei sistemi e nei sensori di imaging termico.
- Materiali luminescenti: funge da materiale ospite per creare composti luminescenti, come il solfuro di zinco drogato con rame per applicazioni fosforescenti.
- Applicazioni dei semiconduttori: nei transistor a film sottile e in altri dispositivi a semiconduttore, le pellicole di solfuro di zinco svolgono un ruolo importante nei componenti elettronici.
- Fosfori per display a LED: i display a LED utilizzano fosfori di solfuro di zinco per migliorare il colore e la luminosità.
- Rilevamento di raggi X e raggi gamma: i rilevatori a scintillazione utilizzano le proprietà scintillanti del solfuro di zinco per rilevare raggi X e raggi gamma.
- Pigmenti e vernici: i pigmenti bianchi nelle vernici, nei rivestimenti e negli inchiostri da stampa utilizzano forme specifiche di solfuro di zinco come il bianco di zinco o il litopone.
- Marcatori fluorescenti: nelle applicazioni biologiche, i ricercatori funzionalizzano nanoparticelle di solfuro di zinco per marcatori fluorescenti negli studi di imaging.
- Celle solari: gli scienziati stanno studiando le nanoparticelle di solfuro di zinco per determinare il loro potenziale nel migliorare l’assorbimento della luce nelle celle solari fotovoltaiche.
- Catalisi: esplorando la sua natura di semiconduttore, i ricercatori stanno studiando le proprietà catalitiche del solfuro di zinco in varie reazioni chimiche.
- Finestre a infrarossi: dispositivi ottici come fotocamere, telescopi e sensori che incorporano solfuro di zinco per finestre a infrarossi.
La versatilità del solfuro di zinco deriva dalla sua capacità di mostrare luminescenza, trasparenza e comportamento da semiconduttore. Le sue applicazioni su misura contribuiscono in modo significativo a campi quali l’ottica, l’elettronica, l’energia e la scienza dei materiali.
Domande:
D: Qual è la formula del solfuro di zinco?
R: La formula del solfuro di zinco è ZnS.
D: Il solfuro di zinco è solubile?
R: Il solfuro di zinco è generalmente insolubile in acqua.
D: Lo ZnS è solubile in acqua?
R: No, ZnS non è solubile in acqua.
D: Il solfuro di zinco contiene il 67,1% di zinco in massa. Qual è la frazione in massa dello zolfo nel solfuro di zinco?
R: La frazione di massa dello zolfo nel solfuro di zinco è del 32,9%.
D: Come è possibile separare il cloruro di zinco dal solfuro di zinco?
R: Il cloruro di zinco e il solfuro di zinco possono essere separati sciogliendo il cloruro di zinco in acqua, lasciando dietro di sé il solfuro di zinco insolubile.
D: Il solfuro di zinco è ionico?
R: Sì, il solfuro di zinco è principalmente ionico.
D: Che tipo di difetto stechiometrico è rappresentato dallo ZnS?
R: Il solfuro di zinco può presentare difetti stechiometrici di tipo Frenkel.
D: Cos’è lo ZnS?
R: ZnS è la formula chimica del solfuro di zinco, un composto di zinco e zolfo.
D: Qual è il pH minimo richiesto per prevenire la precipitazione di ZnS?
R: Il pH minimo richiesto per prevenire la precipitazione di ZnS è circa 4,7.
D: Questa immagine mostra la cella unitaria cubica per ZnS. Quanti ioni Zn²⁺ ci sono in questa cella cubica?
R: Nella cella cubica di ZnS ci sono quattro ioni Zn²⁺.
D: ZnS è ionico o covalente?
R: ZnS è considerato principalmente ionico.
D: Che tipo di reazione è Zn + S = ZnS?
R: La reazione Zn + S = ZnS è una reazione di sintesi o di combinazione.
